Ⅰ. 서 론
Catechin은 식물에서 항산화 작용을 하는 2차 대사산물 일종인 flavan-3-ol로 플라보노이드로 불리는 폴리페놀에 속하는 화합물이다. Catechin은 구조적으로 C-3에 hydroxyl기(—OH)를 가진 2개의 벤젠 고리(A-및 B-고리라고 함)와 dihydropyran heterocycle(C-고리)을 가지고 있다(1). 또한, A-고리는 resorcinol moiety 및 B-고리는 catechol moiety와 유사하며, C-2와 3에는 2개의 chiral 탄소가 있어 4개의 diastereomer(부분입체이성질체)를 가지고 있다(Figure 1). 이성질체 중 2개는 trans형으로 catechin으로, 다른 2개는 cis형으로 epicatechin이라 불리며(Figure 1), 특히 (+)-catechin은 녹차(Camellia sinensis)와 식물에서 많이 함유된 catechin으로 식물 폴리페놀 화합물 중 가장 많이 연구된 화합물이다(2). 또한, (+)-catechin은 항산화, 항암 및 항염증 활성 등의 광범위한 효능을 나타내는 것으로 알려져 있으며, 녹차와 카카오(Theobroma cacao) 등의 천연물에 광범위하게 함유되어 있어 식품으로부터 쉽게 섭취할 수 있다(2). 그러나 플라보노이드로서 catechin은 in vitro에서 고농도로 존재 시 항산화 물질로 작용할 수 있지만, 다른 플라보노이드와 비교할 때 항산화 잠재력은 낮다고 알려져 있다(3). 또한, 추출된 식물 폴리페놀로부터 얻은 플라보노이드의 항산화 활성은 체내에서 단지 수 시간으로 제한되고 pro-oxidant로서 작용할 뿐만 아니라, H2O2 등의 활성산소종(ROS)을 생성하는 것과 달리(4), 상대적인 고분자 획분은 증강된 생리활성과 in vivo에서의 비교적 긴 활성시간을 가지고 있음이 보고되고 있으며(5), 고분자량 식물 폴리페놀은 또한 pro-oxidant 효과도 보이지 않음이 알려져 있다(6, 7).
한편, 효소의 특이적인 촉매작용을 이용하여 종래의 방법, 특히 유기합성 반응으로는 얻을 수 없었던 신소재를 새롭게 합성하는 기술이 최근 주목을 받고 있다. 효소반응은 화학적 촉매와 달리 촉매활성이 높고, 반응조건이 까다롭지 않으며, 높은 입체ᆞ위치 및 관능기 선택성, 부반응의 억제와 효소 반응계의 무독성 등 많은 이점이 있으므로 다양한 산업 분야에서 이용되고 있고, 점차 그 이용 분야가 확대되고 있다(8). 또한, 이러한 특징 때문에 효소를 이용하는 물질 생산에 관한 관심이 고조되고 있어, 식품 및 제약 산업에서도 비교적 활발하게 활용되고 있다(9). 특히, 효소 촉매 중합(enzymatic polymerization)은 ‘효소의 촉매작용을 이용한 비 생합성 경로에 의한 in vitro 중합반응’으로, 기능성 고분자 재료 개발에 있어서 정밀 구조제어의 필요성이 높아지고 있고, 여기에 대응할 수 있는 고분자 합성의 새로운 수법으로써 효소 촉매 중합이 관심을 끌고 있다. 그러나 녹차의 대부분 연구는 catechin류에 집중되어 있고, 중합체에 관한 연구는 거의 전무한 실정에서 녹차에 풍부한 카테킨류를 활용하여 효소 공학적 방법에 따라 중합체로 전환해 새로운 활성소재로 개발하는 연구는 고부가가치가 예상되는 시급한 연구 분야로 생각한다.
특히, 이전 연구(10)에서 (—)-catechin을 기질로 중합체 형성의 반응조건을 검토한 결과, catechin-중합체는 형성되었으나, (—)-catechin 기질보다 항산화 활성이 낮았다. 따라서, 본 연구에서는 녹차 catechin류로 함유량이 높은 (+)-catechin을 유기용매 용액에서 laccase 효소반응으로 신규 생성되는 중합체 화합물을 HPLC로 확인하여 중합체 형성의 반응조건을 확립하고 항산화 활성을 평가하여 녹차 catechin-중합체를 기능성식품 또는 화장품의 소재로 활용하기 위한 기초자료를 마련하고자 하였다.
Ⅱ. 실험재료 및 방법
Catechin-중합체 생성 효소인 laccase는 DeniLite IIS Novo Nordisk®[Aspergillus oryzae 유래, 120 laccase myceliophthora unit(LAMU)/g]를 Novozymes사(Bagsværd, Denmark)로부터 구매하여 사용하였다. 또한, catechin-중합체 생성에 이용되는 laccase 기질인 (+)-catechin 표준물질은 Sigma-Aldrich(St. Louis, MO, USA)로부터 구매하였고, (+)-catechin 및 그 중합체의 HPLC 분석을 위한 용매로 사용한 아세트산은 Junsei (Tokyo, Japan), acetonitrile은 J.T. Baker(Fischer Scientific, Hampton, NH, USA)에서 구매하였다.
Yu는 (—)-catechin 표준품을 기질로 이용하여 laccase와 반응시켜 항산화 활성이 증진된 중합체 생성의 최적화 실험을 진행한 결과, catechin-중합체의 생성량도 적고 항산화 활성도 증진되지 않았음을 보고하였다(10). 따라서, 본 연구에서는 녹차 catechin류 중 함량이 높은 (+)-catechin 기질을 이용하여 항산화 활성이 높은 catechin-중합체 생성의 최적 조건을 확립하였다. 또한, 시판 laccase는 다양한 부형제를 포함하고 있어 일반적인 교반법으로는 효소가 충분히 용출되지 않음을 확인하고 활성에 저해가 없는 조건에서 sonication으로 효소 추출을 최적화하였다. 기질 및 효소의 조제와 기본 효소 반응액 구성은 Table 1A와 같고, 최적화 관련 효소반응은 조건별로 실험이 진행되면서 반복적으로 실행될 뿐만 아니라, scanning 결과 큰 차이를 보이지 않기 때문에 모든 조건에서 단회 반응을 통하여 중합체 형성의 결과를 분석하였다.
Laccase에 의한 (+)-catechin 중합반응으로 생성된 중합체를 확인하기 위하여 일정 반응시간 후에 반응액을 원심분리(12,000 rpm, 10분)하여 상등액과 침전물로 분리하였다. 다음으로 상등액은 농축 후 동결건조하고 침전물은 buffer로 씻은 후 DIW에 대하여 투석(MW cut-off 1,000, Sigma-Aldrich) 및 농축 후 동결건조하여 분석에 사용하였다. 또한, 중합체 생성의 확인을 위해서 (—)-catechin의 실험처럼 HPLC로 분석하는 경우, 장시간이 걸려 산업적 활용면에서 제한적이기 때문에, UV-visible 영역(250~450 nm)에서 scanning하는 방법으로 상등액과 침전물의 흡수영역을 비교하여, 침전물 생성 여부와 함께 상등액과 침전물에서의 생성물 차이를 확인하였다. 또한, 침전물 생성이 적은 (—)-catechin 실험과 달리 (+)-catechin 기질의 경우에는 침전물이 다량 생성되어, 이를 기질 대비 수율로 환산하고 효소 반응조건을 검토하였다. 또한, 중합체 침전물 생성이 양호한 효소 반응조건에서 회수한 침전물은 (—)-catechin 실험조건(Table 1B)으로 HPLC 분석을 진행하여 중합체를 확인하였다(10).
(+)-Catechin 표준품을 기질로 반응온도에 따른 중합체 상당 침전물 생성조건을 검토하기 위하여 효소 반응액에서 기질 농도를 반응액 대비 0.5%(w/v aqueous solution of DIW : MeOH = 95 : 5)로 설정하고, 효소를 1.5%(w/v, 단백질 기준, pH 5.0) 첨가한 후 30, 40과 50°C에서 24시간 반응시켰다. 효소 반응액은 원심분리하여 상등액과 침전물로 분리한 후 상등액은 동결건조하고, 침전물은 buffer로 세척한 후 DIW에서 투석 및 농축 후 동결건조하였다. 동결건조된 상등액과 침전물은 수율을 측정하고 적당한 농도로 희석하여 250~450 nm의 UV-visible 영역에서 scanning을 실시하고, 상등액과 침전물의 흡수영역을 비교하여 중합체 상당 침전물 생성에 대한 반응온도의 영향을 검토하였다.
(+)-Catechin을 기질로 반응 pH에 따른 중합체 상당 침전물 생성에 대한 조건을 검토하기 위하여 효소 반응액에서 기질 농도를 반응액 대비 0.5%(w/v aqueous solution of DIW : MeOH = 95 : 5)로 설정하고, 효소를 1.5%(w/v, 단백질 기준) 첨가한 후 30°C에서 pH를 3.0, 5.0, 7.0과 9.0으로 조정하고 24시간 반응시켰다. 효소 반응액은 위와 동일 방법으로 처리하여 상등액과 침전물을 동결건조한 후 수율을 측정하고, 적당한 농도로 희석하여 UV-visible 영역에서 scanning을 실시하고, 상등액과 침전물의 흡수영역을 비교하여 중합체 상당 침전물 생성에 대한 반응 pH의 영향을 검토하였다.
(+)-Catechin 표준물질을 기질로 laccase 첨가량에 따른 중합체 상당 침전물 생성에 대한 조건을 검토하기 위하여 효소 반응액에서 기질 농도를 반응액 대비 0.5%(w/v aqueous solution of DIW : MeOH = 95 : 5)로 설정하고, 효소의 양을 반응액 대비 단백질 기준으로 0.5, 1.5, 3.0과 5.0%(w/v, 단백질 기준, pH 5.0)로 첨가하여 30°C에서 24시간 반응시켰다. 효소 반응액은 위와 동일 방법으로 처리하여 상등액과 침전물을 동결건조한 후 수율을 측정하고, 적당한 농도로 희석하여 UV-visible 영역에서 scanning을 실시하고, 상등액과 침전물의 흡수영역을 비교하여 중합체 상당 침전물 생성에 대한 효소 첨가량의 영향을 검토하였다.
(+)-Catechin의 기질 첨가량에 따른 중합체 상당 침전물 생성에 대한 조건을 검토하기 위하여 효소 반응액에서 기질 농도를 반응액 대비 0.2, 0.5, 1.0과 3.0%(w/v aqueous solution of DIW : MeOH = 95 : 5)로 설정하고, 효소를 1.5%(w/v, 단백질 기준, pH 5.0) 첨가한 후 30°C에서 24시간 반응시켰다. 효소 반응액은 위와 동일 방법으로 처리하여 상등액과 침전물을 동결건조한 후 수율을 측정하고, 적당한 농도로 희석하여 UV-visible 영역에서 scanning을 실시하였으며, 상등액과 침전물의 흡수영역을 비교하여 중합체 상당 침전물 생성에 대한 기질 첨가량 영향을 검토하였다.
녹차 catechin류 화합물에는 다양한 polyphenol 화합물이 함유되어 있어 이들에 대한 laccase의 중합체 생성반응이 원활하게 일어날 수 있는지를 확인하기 위해 입수가 가능한 epicatechin, EGCG와 녹차 catechin류 화합물에서 gallic acid (GA)를 제거한 생리활성이 증진된 고부가가치 소재를 (+)-catechin과 함께 기질로 이용하여 침전물 생성에 대한 기질특이성을 검토하고자 하였다. 효소 반응액에서 기질 농도는 0.5%(w/v aqueous solution of DIW : MeOH = 95 : 5)로 설정하고 효소를 1.5%(w/v, 단백질 기준, pH 5.0) 첨가한 후 30°C에서 24시간 반응시켰다. 효소 반응액은 위와 동일 방법으로 처리하여 상등액과 침전물을 동결건조한 후 수율을 측정하고 적당한 농도로 희석하여 UV-visible 영역에서 scanning을 실시하고, 상등액과 침전물의 흡수영역을 비교하여 중합체 상당 침전물 생성에 대한 기질 종류의 영향을 검토하였다.
Laccase의 중합체 생성 반응조건에서 (+)-catechin으로부터 생성된 중합체 상당 침전물의 항산화 활성은 DPPH(1,1-diphenyl-2-picrylhydrazyl, Sigma-Aldrich) radical을 이용한 Cheung 등(11)의 방법을 변형하여 라디칼 소거능으로 측정하였다. 즉, DPPH radical 용액(0.2 mM)에 시료 50 μL를 가한 후 상온에서 30분 방치하고 517 nm에서 반응액의 흡광도 변화를 측정하였다. 표준물질로는 5 mM L-ascorbic acid를 이용하여 표준곡선을 작성한 후 적정농도를 찾아 동량 첨가하였다. 총산화력은 시료 100 g 중 ascorbic acid 표준물질과 비교한 ascorbic acid equivalent antioxidant capacity(AEAC)로 나타내었다. 또한, ABTS cation decolorization assay에 의한 총항산화력은 Choi 등(12)의 방법에 따라 측정하였다. 즉, 7.4 mM ABTS[2,2'-azino-bis-(3-ethylbenzothiazoline-6-sulfonic acid, Sigma-Aldrich)와 2.6 mM potassium persulphate를 하루 동안 암소에서 방치하여 ABTS 양이온을 형성시킨 후, 이 용액을 734 nm에서 흡광도 값이 1.5가 되도록 몰 흡광계수(ε = 3.6 × 104 M—1 cm—1)를 이용하여 증류수로 희석하였다. 이 용액에 시료 50 μL를 가한 후 상온에서 60분간 방치하여 반응액의 흡광도 변화를 측정하였다. 표준물질로는 5 mM L-ascorbic acid를 사용하여 총산화력은 DPPH와 같이 시료 100 g 중 AEAC로 나타내었다.
Ⅲ. 실험 결과 및 고찰
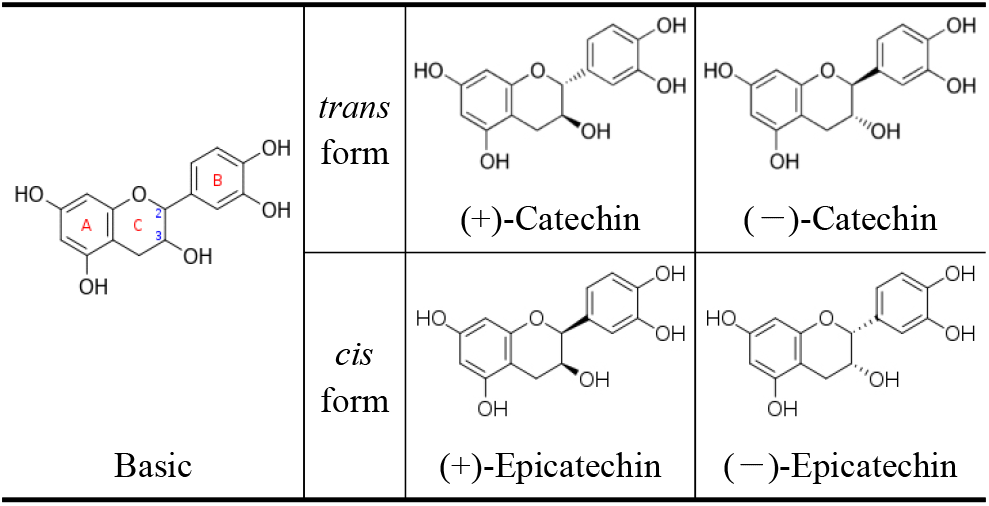
Laccase에 의한 (+)-catechin 중합반응으로 생성된 중합체를 확인하기 위하여 일정 반응시간 후에 반응액을 원심분리(12,000 rpm, 10분)하여 상등액과 침전물로 분리하고 침전물은 buffer로 세척한 후 DIW에 대하여 투석 및 농축 후 동결건조하였다. 한편, (+)-catechin은 270 nm에서 최대 흡수되는 것과 중합체가 형성되면 phenol ring 화합물의 중합으로 흡수 파장이 후반부로 이동하는 것으로 알려져 있으므로(13~15), 이를 이용하여 250~450 nm의 UV-visible 영역에서 동결건조된 상등액과 침전물의 흡수영역을 비교하였다. Figure 2A와 같이 반응 상등액에서는 270 nm의 흡수영역을 보여주었으나, laccase로 효소반응 후 얻은 침전물에서는 270 nm 흡수 파장은 붕괴하고, 310~430 nm의 넓은 UV-visible 영역에서 기질과는 다른 흡수영역이 형성됨을 나타내었다.
또한, 동결건조된 상등액과 침전물을 DMSO에 용해한 후 Table 1B의 HPLC 분석조건으로 침전물의 peak 양상을 확인한 결과에서도(Figure 2B, C), (—)-catechin 중합체 실험에서와 마찬가지로 기질 및 효소 대조군이나 반응 상등액에는 없었던 peak도 관찰되어, UV-visible scanning 분석과 함께 catechin-중합체 상당의 물질이 침전물에 생성되었음을 확인할 수 있었다.
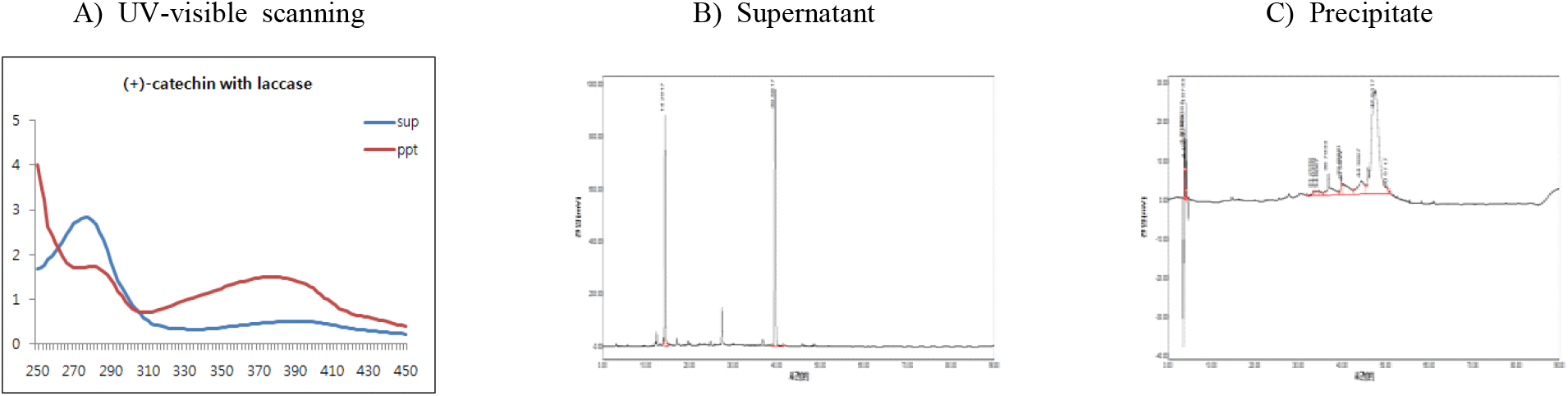
(+)-Catechin을 기질로 반응온도에 따른 중합체 상당 침전물의 생성조건을 검토하기 위하여 효소 반응액에서 기질 농도를 반응액 대비 0.5%(w/v aqueous solution of DIW : MeOH = 95 : 5)로 설정하고, 효소를 1.5%(w/v, 단백질 기준, pH 5.0) 첨가한 후 30, 40과 50°C에서 24시간 반응시켰다. 효소반응 종료 후 동결건조된 침전물의 수율은 30°C에서 65.3%, 40°C에서 70.1%를 보였으며, 50°C의 약간 높은 온도에서는 58.7%로 감소하였다(Table 2).
또한, 반응액을 원심분리한 상등액과 침전물의 동결건조물에 대한 250~450 nm에서 UV-visible scanning 분석결과(Figure 3), 모든 반응온도에서 상등액에 검출되는 270 nm의 (+)-catechin 흡수 파장이 침전물에서는 붕괴하면서 310~430 nm의 넓은 UV-visible 영역에서 새로운 흡수 파장이 생성됨을 보여주어 기질의 효소작용에 기인하는 물질변환이 유도되고 있음을 보여주었다. 또한, 반응온도에 따른 새로운 흡수 파장 발생은 30°C와 40°C에서 50°C보다 큰 차이로 생성됨을 나타내어 수율과 함께 30°C의 효소반응 온도가 최적임을 나타내었다.
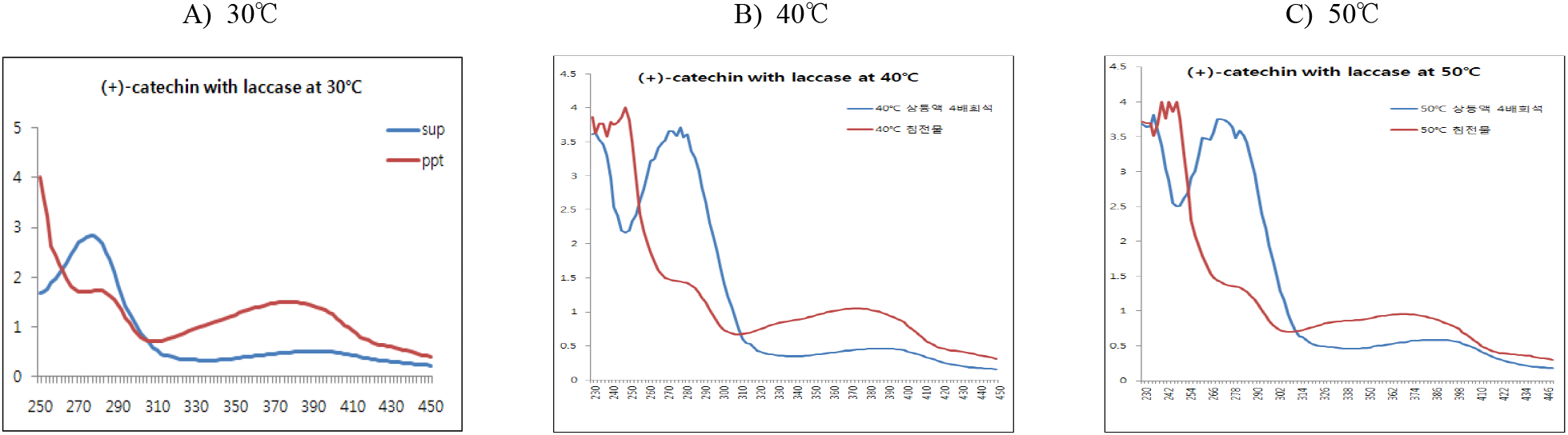
(+)-Catechin을 기질로 반응 pH에 따른 중합체 상당 침전물 생성에 대한 조건을 검토하기 위하여 효소 반응액에서 기질 농도를 반응액 대비 0.5%(w/v aqueous solution of DIW : MeOH = 95 : 5)로 설정하고, 효소를 1.5%(w/v, 단백질 기준) 첨가한 후 30°C에서 pH를 3.0, 5.0, 7.0과 9.0으로 나누어 24시간 반응시켰다. 효소반응 종료 후 동결건조된 침전물의 수율은 pH 3.0에서 61.3%, pH 5.0에서 63.0%, pH 7.0에서는 68.7%로 큰 차이를 보이지 않았으나, 알칼리(pH 9.0)에서는 27.4%로 현저히 감소하였다(Table 2).
한편, 반응액을 원심분리한 상등액과 침전물의 동결건조물에 대한 250~450 nm에서 UV-visible scanning 분석결과(Figure 4), 모든 반응 pH에서 상등액에 검출되는 270 nm의 (+)-catechin 흡수 파장이 침전물에서는 붕괴하면서 310~430 nm의 넓은 UV-visible 영역에서 새로운 흡수 파장이 생성됨을 보여주어 기질의 효소작용에 기인하는 물질변환이 유도되고 있음을 보여주었다. 그러나 반응 pH에 따라 새로운 흡수영역에서 차이를 나타내었는데, pH 3.0과 pH 9.0의 산성과 알칼리에서는 적었고, pH 5.0에서 가장 큰 영역을 나타내었으며, 다음으로 pH 7.0이 관찰되어, pH 5.0이 laccase 최적 반응조건임을 나타내었다.
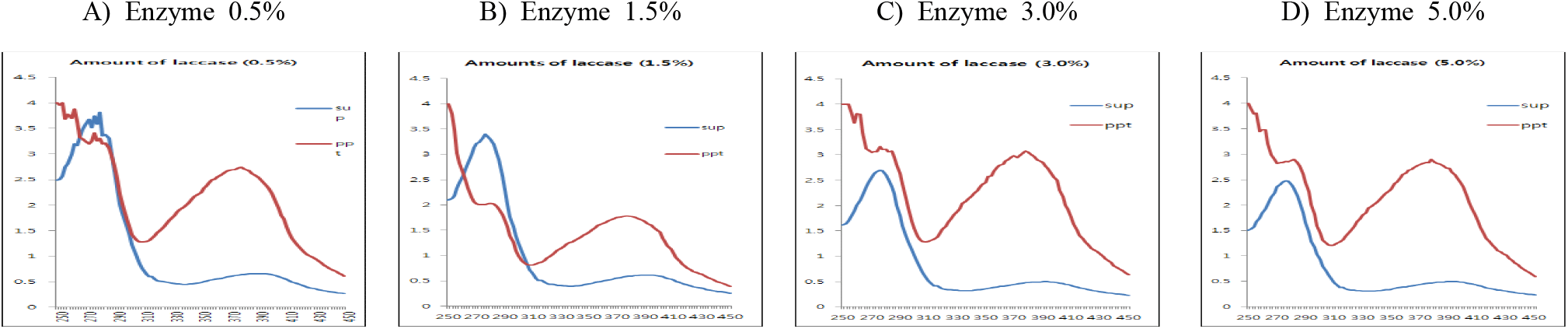
(+)-Catechin을 기질로 laccase 첨가량에 따른 중합체 상당 침전물 생성에 대한 조건을 검토하기 위하여 효소 반응액에서 기질 농도를 반응액 대비 0.5%(w/v aqueous solution of DIW : MeOH = 95 : 5)로 설정하고, 효소의 양을 반응액 대비 단백질 기준으로 0.5, 1.5, 3.0과 5.0%(w/v, 단백질 기준, pH 5.0)로 첨가하여 30°C에서 24시간 반응시켰다. 효소반응 종료 후 동결건조된 침전물의 수율은 효소첨가량 증가와 함께 침전물 수율도 증가하여 0.5% 첨가 시에는 33.4%로 현저하게 감소하였으나, 1.5% 이상에서는 농도 의존적으로 증가함을 확인할 수 있었다(Table 2).
한편, 반응액을 원심분리한 상등액과 침전물의 동결건조물에 대한 250~450 nm에서 UV-visible scanning 분석결과(Figure 5), 모든 효소 첨가량 조건에서 상등액에 검출되는 270 nm의 (+)-catechin 흡수 파장이 침전물에서는 붕괴하면서 310~430 nm의 넓은 UV-visible 영역에서 새로운 흡수 파장이 생성됨을 보여주어 기질의 효소작용에 기인하는 물질변환이 유도되고 있음을 보여주었다. 또한, 효소 첨가량에 따라 새로운 흡수영역에서의 차이는 나타나지 않아, 본 실험에서 사용한 기질 농도의 범위 내에서는 수율의 차이만을 나타낼 뿐 형성된 중합체 상당 침전물의 구조적 특성은 큰 차이를 보이지 않는 것으로 나타났으며, 수율을 고려할 때 반응액 대비 1.5%의 효소 단백질이 첨가되는 수준이 중합반응의 최적 조건임을 보였다.
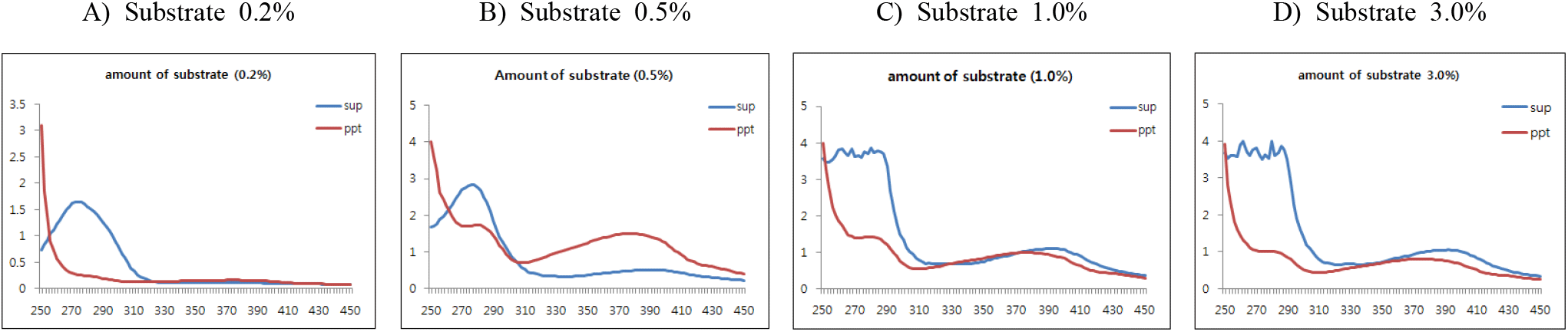
(+)-Catechin의 기질 첨가량에 따른 중합체 상당 침전물 형성에 대한 조건을 검토하기 위하여 효소 반응액에서 기질 농도를 반응액 대비 0.2, 0.5, 1.0과 3.0%(w/v aqueous solution of DIW : MeOH = 95 : 5)로 설정하고, 효소를 1.5%(w/v, 단백질 기준, pH 5.0) 첨가한 후 30°C에서 24시간 반응시켰다. 효소반응 종료 후 동결건조된 침전물의 수율은 기질 첨가량 증가와 함께 침전물의 수율이 감소하여 0.2% 첨가 시에는 92.5%로 현저히 높았고, 0.5%에서 67.5%의 수율을 보였으나 효소 대비 기질량의 과잉으로 1.0과 3.0%에서는 첨가량과 반비례하여 급속도로 침전물 형성이 감소함을 확인하였다(Table 2).
한편, 반응액을 원심분리한 상등액과 침전물의 동결건조물에 대한 250~450 nm에서 UV-visible scanning 분석결과(Figure 6), 모든 기질 첨가조건에서 상등액에 검출되는 270 nm의 (+)-catechin 흡수 파장이 침전물에서는 붕괴하였으나, 기질 농도가 낮은 0.2%의 조건에서는 310~430 nm의 새로운 흡수 파장이 생성되지 않았고, 1.0%와 3.0%에서는 수율은 현저히 낮았으나, 작은 새로운 흡수영역이 형성됨을 보여주어 기질 농도에 따라 효소가 크게 영향을 받음을 알 수 있었다. 또한, 이러한 새 흡수영역은 0.5% 기질 첨가조건에서 크게 형성됨을 나타내어 효소작용에 기인하는 물질변환이 유도되고 있음을 보여주어 수율과 중합체 생성을 고려할 때 단백질 대비 효소 첨가가 1.5% 수준인 경우, 반응액 대비 0.5%의 기질 첨가 수준이 가장 효율적임을 알 수 있었다.
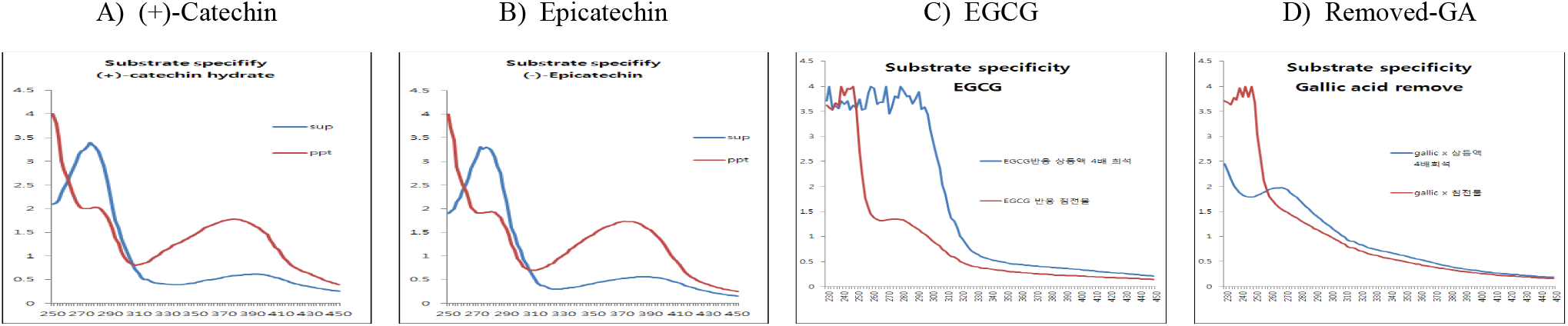
녹차 catechin류 화합물에는 다양한 polyphenol 화합물이 함유되어 있어 이들에 대한 laccase의 중합체 형성반응이 원활하게 일어날 수 있는지를 확인하기 위해 epicatechin, EGCG와 함께 녹차 catechin류에서 gallic acid를 제거한 생리활성이 증진된 고부가가치 소재를 기질로 이용하여 laccase의 기질특이성을 검토하였다. 효소반응 종료 후 동결건조된 침전물의 수율은 기질에 따라 큰 차이를 보이지는 않았으나, (+)-catechin과 epicatechin 기질이 유사한 수율을 보였으나, gallic acid를 제거한 녹차 catechin 효소 전환물과 EGCG의 경우에는 침전물의 수율이 감소함을 나타냈다(Table 2).
그러나 반응액을 원심분리한 상등액과 침전물의 동결건조물에 대한 250~450 nm에서 UV-visible scanning 분석결과(Figure 7), (+)-catechin과 epicatechin 기질의 경우에는 상등액에 검출되는 270 nm의 (+)-catechin 흡수 파장이 침전물에서는 붕괴하면서 310~430 nm의 넓은 UV-visible 영역에서 새로운 흡수 파장이 생성됨을 보여주어 기질의 효소작용에 기인하는 물질변환이 유도되고 있음을 보여주었다. 그러나 EGCG와 효소 전환물(removed-GA; 녹차 catechin류 화합물-효소 처리로 gallic acid 제거)의 경우에는 반응 상등액의 흡수패턴도 다를 뿐만 아니라, 새로운 흡수영역이 거의 생성되지 않고, 310~410 nm의 UV-visible 영역도 거의 반응 상등액과 유사한 패턴을 보여 침전물은 생성되었으나, 침전물 구성 물질 또는 그 구조가 표준물질들과는 다른 경향을 나타냄으로써 EGCG와 GA-제거 효소 전환물을 Table 1B의 분석조건에 따라 HPLC로 확인하였다.
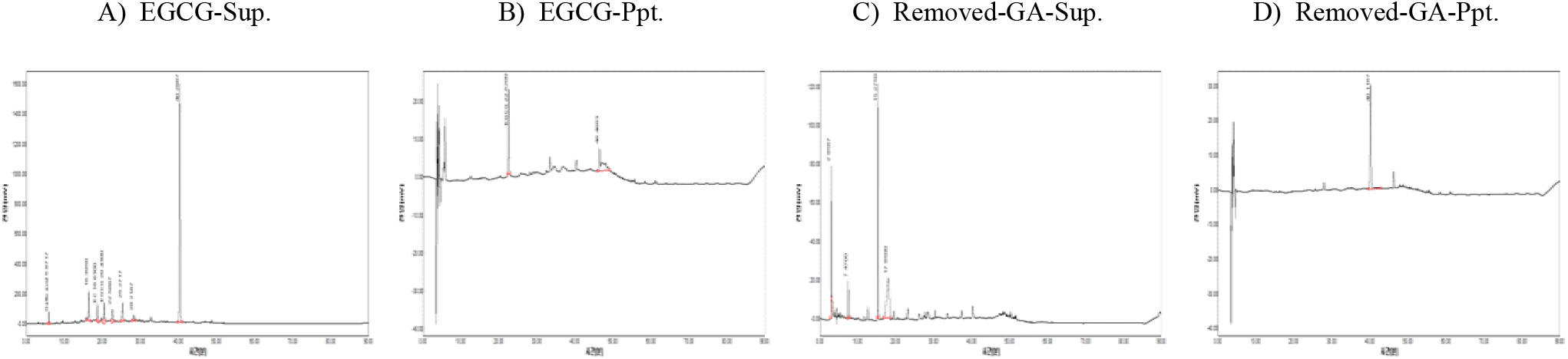
그 결과 EGCG(Figure 8A, B)와 효소 전환물(removed-GA, Figure 8C, D) 모두에서 침전물에 분포하는 것으로 보이는 중합체 상당 peak가 catechin 또는 epicatechin 표준물질과 비교하여 적거나 효소 전환물의 경우에는 거의 검출되지 않음으로써 중합체 생성이 쉽지 않은 것으로 추정되어, 향후 시판되고 있는 녹차 catechin류 화합물에 직접 laccase를 적용하여 중합체 형성 가능성을 검토할 계획이다.
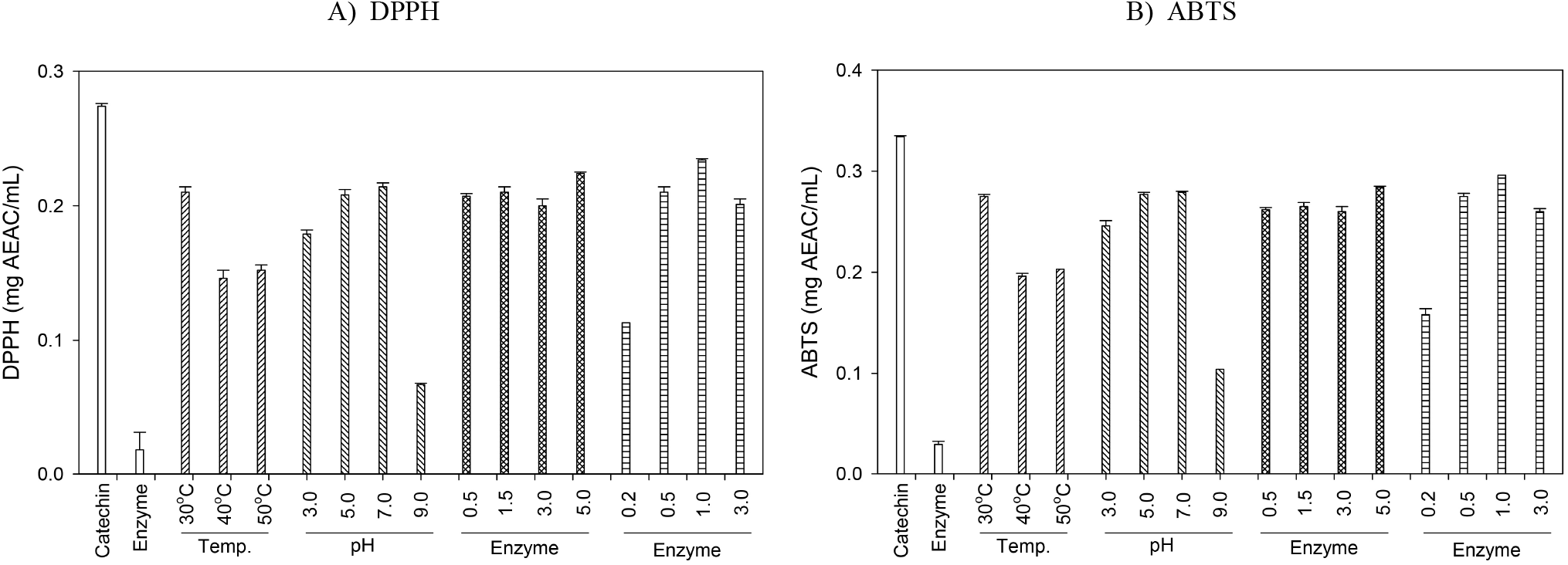
Laccase를 산화중합 효소로 이용하여 다양한 효소 반응조건에서 (+)-catechin을 기질로 생산된 중합체 상당 침전물의 항산화 활성은 DPPH와 ABTS의 radical 소거 능을 시료 mL 중 표준물질인 ascorbic acid와 비교산출한 ascorbic acid equivalent antioxidant capacity(AEAC)로 나타내었다. DPPH와 ABTS 항산화 활성 모두 기질인 catechin보다 활성이 높지는 않았으나, 효소반응 조건에 따라서는 수율 및 UV-visible scanning 결과와 일치되는 우수한 항산화 활성의 경향을 나타내었다. 반응온도에서는 30°C가, 반응 pH에서는 7.0, 효소 첨가량은 활성에는 큰 영향을 주지 않아 단순히 수율에서 영향을 주는 것으로 형성된 중합체의 물질구성 또는 구조적으로는 유사한 것으로 보인다. 또한, 기질 농도에 따라서는 1.0% 첨가군에서 가장 높은 라디칼 소거능의 항산화 활성을 나타내었다(Figure 9). 그러나 본 연구개발의 목적인 (+)-catechin 기질보다 항산화 활성이 증진된 중합체의 생성측면에서는 만족할 만한 성과를 거두지 못하여, 향후 시판 catechin류 화합물에 laccase를 적용하여 항산화 활성이 증진된 중합체의 생성이 가능한지를 확인하고자 한다.
Ⅳ. 결 론
(—)-카테킨으로부터 중합체를 생산하는 반응조건을 조사한 결과, 카테킨 중합체는 생산되었으나, 항산화 활성은 (—)-카테킨 기질보다 낮았다. 따라서 본 연구에서는 녹차 카테킨 중 가장 함량이 높은 (+)-catechin을 사용하여 laccase에 의한 항산화 활성을 갖는 (+)-catechin-polymer의 제조를 위한 반응조건을 확립하였다. 또한, HPLC 분석과 함께 (+)-catechin-중합체의 존재를 확인하기 위해 UV-visible(250~450 nm) 영역에서 scanning 방법을 이용하여 상등액과 침전물의 흡수영역을 비교하였다. Laccase에 의해 유도된 (+)-catechin-중합체 생산을 위한 최적 온도와 pH는 30°C와 pH 5.0이었다. 또한, laccase 함량 1.5%와 기질 함량 0.5%에서 최적의 (+)-catechin-중합체 생성이 이루어졌다. 한편, laccase 기질특이성은 (+)-catechin과 epicatechin은 효율적이었으나, EGCG와 removed-GA는 그렇지 못했다. 그러나 (+)-catechin-중합체의 생성에도 불구하고, (—)-catechin-중합체의 경우와 같이 항산화 활성을 증가시키지 않았기 때문에, 향후 녹차 카테킨류 화합물 중 적합한 기질을 찾고자 한다.