Ⅰ. 서 론
상피 성장 인자 수용체(EGFR)는 세포 성장, 증식, 분화 및 조직 재생을 조절하는 세포 표면 수용체의 중요한 계열이다. 이 중 Amphiregulin과 Epiregulin은 epidermal growth factor(EGF) 계열에 속하는 핵심 구성원이다(1, 2). AREG와 EREG는 EGFR에 결합하여 하류 신호 전달 경로를 활성화함으로써 정상적인 생리 기능과 다양한 병리 과정에 깊이 관여한다. AREG는 유선 상피세포에서 ADAM17에 의해 막 통과 형태로부터 분리되어 기질 EGFR의 파라크린 활성화를 유도하며, 유선 상피 발달을 조절한다. AREG는 유선뿐만 아니라 다양한 조직에서 발현되며 특히 유방암, 간암, 대장암 등 여러 암 종류에서 발현량이 증가하는 것으로 알려져 있다. 특히 AREG는 유방암에서 세포 증식, 침윤, 전이 등 다양한 핵심적인 역할을 하는데 예를 들어, 에스트로겐 수용체(ERa) 양성 유방암 세포에서 에스트로겐 자극은 AREG 발현을 조절하며 세포 증식을 촉진한다(3). AREG는 에스트로겐 신호 전달의 중요한 조절자로 작용한다.
EREG는 EGFR 및 ErbB4에 결합하여 수용체의 동형이합체 및 모든 가능한 이형이합체 ErbB4 복합체를 자극하고, MEK/ERK, PI3K/AKT/mTOR 등 다양한 하위 경로를 활성화시켜 세포 증식, 생존, 이동, 분화 등의 세포 반응을 조절한다(4, 5). 다양한 인체 암에서 과발현되며 종양 진행 및 전이에 관여한다. AREG와 마찬가지로 유방암 발생에 핵심 ligand이다. 삼중 음성 유방암(TNBC)에서 핵심 역할을 수행한다(6). 삼중 음성 유방암은 에스트로겐 수용체, 프로게스테론 수용체(ER), HER2 발현이 없는 암으로 치료가 제한적이다. 이러한 유형에서 EREG는 ER과 HER2에 대한 대안적 신호가 되며, 실제로 IGFBP-3(insulin-like growth factor-binding protein-3)는 삼중 음성 유방암 세포의 성장을 촉진하기 위해 EGFR 신호를 증가시킨다고 알려져 있다(7-9).
본 연구는 유방암 치료의 새로운 전략을 모색하기 위해, 네 가지 암세포주(HCT116, MCF7, HeLa, MDA-MB-231)를 대상으로 AREG와 EREG 발현 패턴을 분석했다. 특히 유방암 세포주인 MCF7, MDA-MB-231에서 AREG와 EREG의 기능적 역할을 규명하기 위해 CRISPR-Cas9을 통한 유전자 녹아웃(knockout)을 유도한 세포주를 확립하는데 성공했다. 여기서 우리는 이를 활용하여 EGFR ligands가 유방암 세포의 성장을 효과적으로 제어할 수 있는지를 정량적으로 평가하여 AREG와 EREG가 유방암 사멸의 새로운 바이오마커로서 활용될 수 있는지 분석했다.
Ⅱ. 본 론
본 논문에서 인간 대장암 세포; HCT116, 인간 유방암 세포; MCF7, MDA-MB-231, 자궁경부암 세포; HeLa가 사용되었고 ATCC로부터 구입되었다. 모든 암세포주들은 Dulbecco’s modified Eagle’s medium(DMEM; Hyclone, SH30243.01)과 10% fetal bovine serum(FBS; Hyclone, SH30919.03) 그리고 1% penicillin/streptomycin(P/S; Hyclone, SH40003.01)로 구성된 배양액에서 배양되었다. 모든 세포는 37℃, 5% CO2 조건을 유지하는 배양기에서 배양되었다.
AREG 또는 EREG를 억제하기 위해 CRISPR-Cas9와 gRNA를 동시에 발현하는 LentiCRISPRv2 벡터가 제작되었다. LentiCRISPRv2 벡터는 15 μg의 polyethylenimine(PEI; Sigma, 408727)을 사용하여 세포에 도입하였다. 벡터가 도입된 세포주에 14일 동안 Puromycin을 처리하여 순수하게 벡터가 도입된 세포를 선별하였다.
본 논문에서 사용된 1차 및 2차 항체는 아래와 같다. Anti-AREG(Abcam, ab180722; 1:2,000 for western blot), anti-EREG (Abcam, ab233512; 1:5,000), anti-a-tubulin(Abcam, ab4074; 1:10,000). HRP-AffiniPure goat anti-mouse IgG(Jackson IR, 115-035-003; 1:20,000), HRP-AffiniPure goat anti-rabbit IgG (Jackson IR, 111-035-003; 1:20,000).
단백질 분석과 정량은 이전에 게재된 논문을 참고하였다(2). 1 × 107의 세포가 분석에 사용되었으며, 세포는 단백질 추출 용액(25 mM Tris-HCl pH 7.6, 150 mM NaCl, 0.1% NP-40, 0.1 mM EDTA, 1% sodium deoxycholate)을 사용하여 5분간 반응하였다. 조건당 20 μg의 단백질이 분석에 사용되었다.
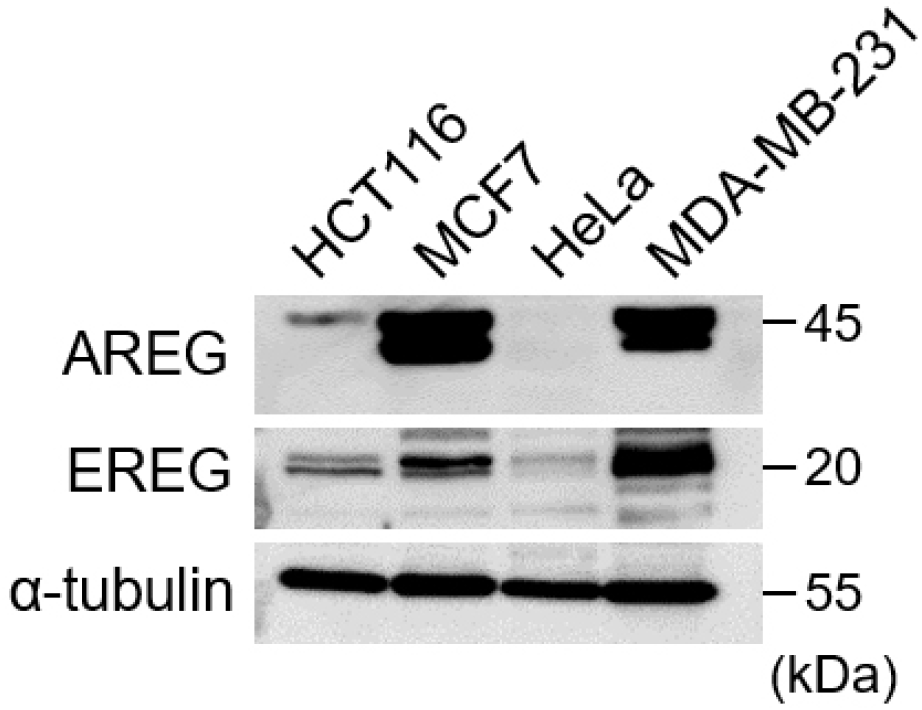
우리는 4개의 암세포주에서 AREG와 EREG의 발현 수준을 파악하기 위해 Western blot 분석을 진행하였다. 유방암 세포주인 MCF7, 삼중 음성 유방암인 MDA-MB-231 세포주에서 AREG와 EREG는 모두 높은 수준으로 발현됨을 확인하였다(Figure 1). HCT116과 HeLa 세포는 유방암 세포주와 비교해서 AREG와 EREG 모두 낮은 수준으로 발현하였다. 이런 결과는 AREG와 EREG가 유방암 세포주에서 특이적인 기능을 수행할 수 있음을 시사한다.
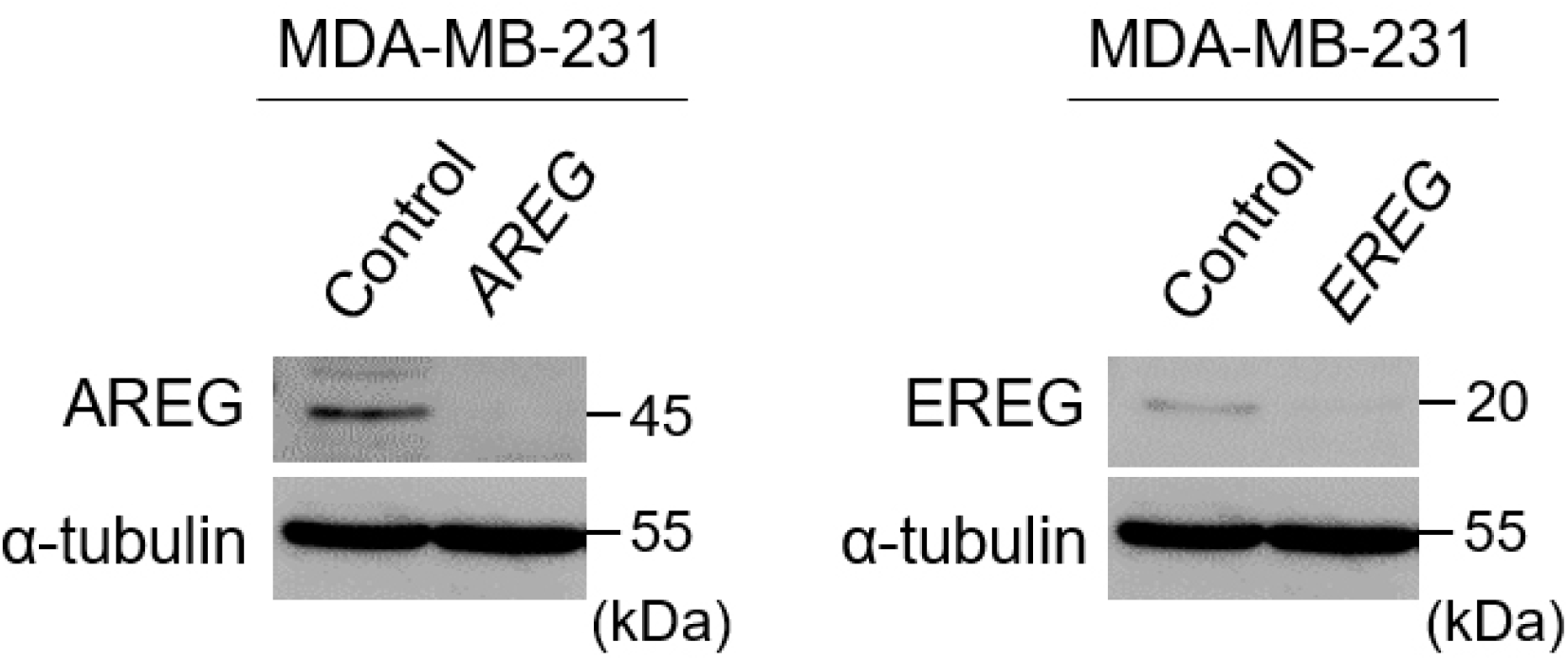
MDA-MB-231 세포주에서 AREG와 EREG의 특이적인 기능을 분석하기 위해 우리는 CRISPR-Cas9 시스템을 사용했다. Cas9와 AREG 또는 EREG를 타깃하는 gRNA를 탑제한 CRISPR-Lentivirus를 제작했고 MDA-MB-231 세포에 48 시간 동안 감염시켰다. 우리가 제작한 LentiCRISPR-Cas9 시스템이 mRNA 전사를 효과적으로 억제하는지 확인하기 위해 western blot을 통해 확인하였다(Figure 2). Control 세포와 비교하여 CRISPR-Cas9가 도입된 세포는 효과적으로 AREG와 EREG의 발현을 억제할 수 있음을 확인하였다.
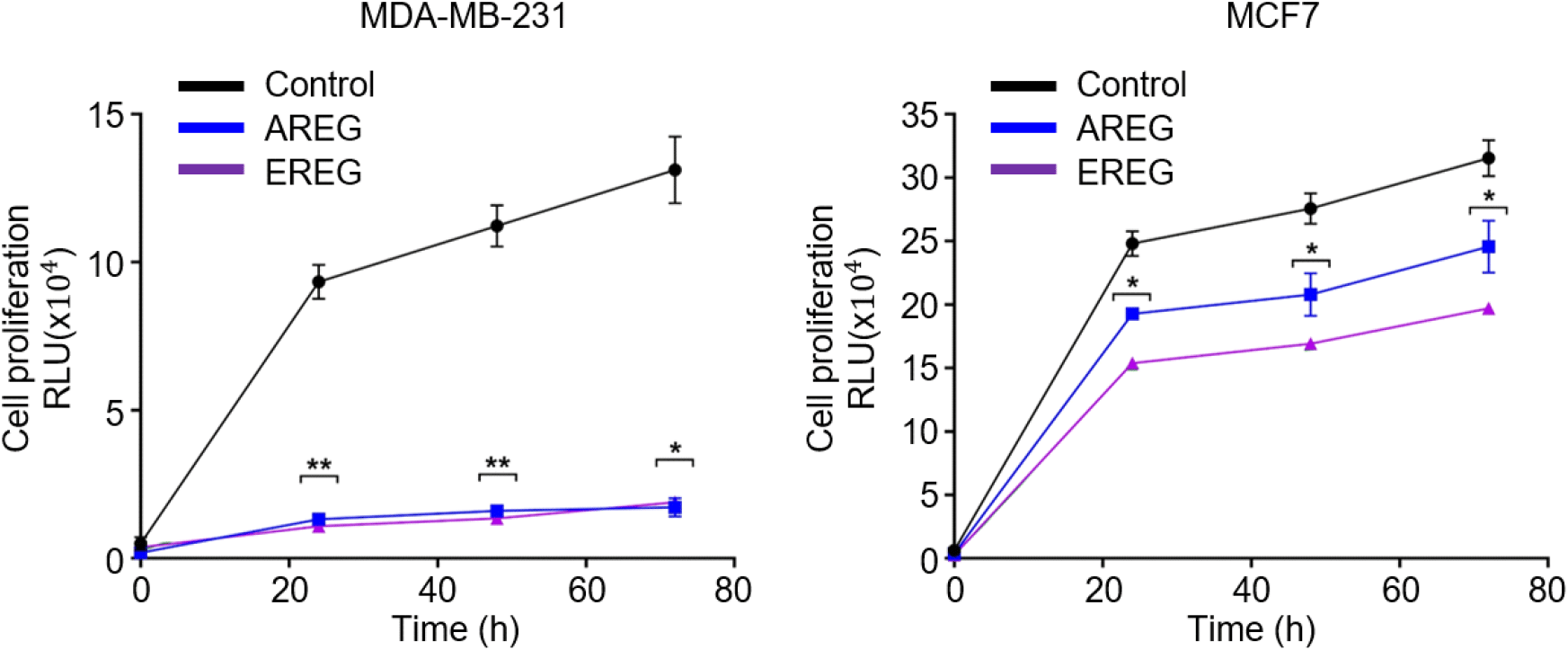
우리는 유방암 세포주에서 AREG 또는 EREG가 과발현되어있고 이것이 암세포 생장에 어떠한 기능을 수행할 것이라고 예상했다. 이것을 증명하기 위해 MDA-MB-231, MCF7에서 CRISPR-Cas9를 활용하여 AREG와 EREG 발현을 억제한 후 CCK-8을 사용하여 세포 사멸 수준을 분석하였다. 우리의 예상대로 AREG와 EREG를 억제한 유방암 세포주의 생장은 일반 유방암 세포주와 비교하여 유의미한 수준으로 감소하였다. 특히 MDA-MB-231은 AREG 또는 EREG 억제 조건에서 세포 생장률은 약 89% 이상 감소함을 확인하였다(Figure 3). 이런 결과는 AREG와 EREG가 유방암 세포의 생장 기전에 중요한 역할을 수행하고 있음을 증명한다.
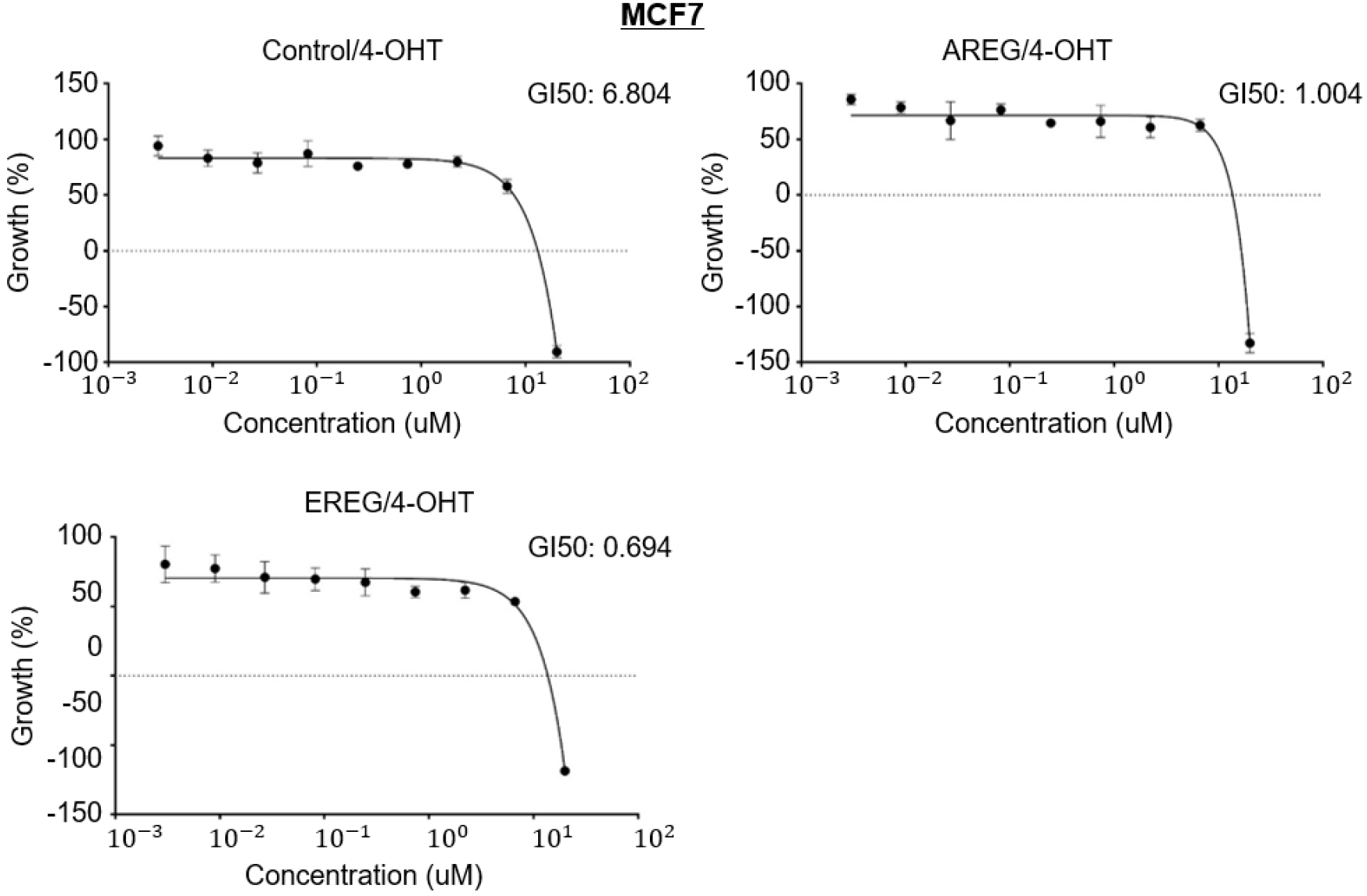
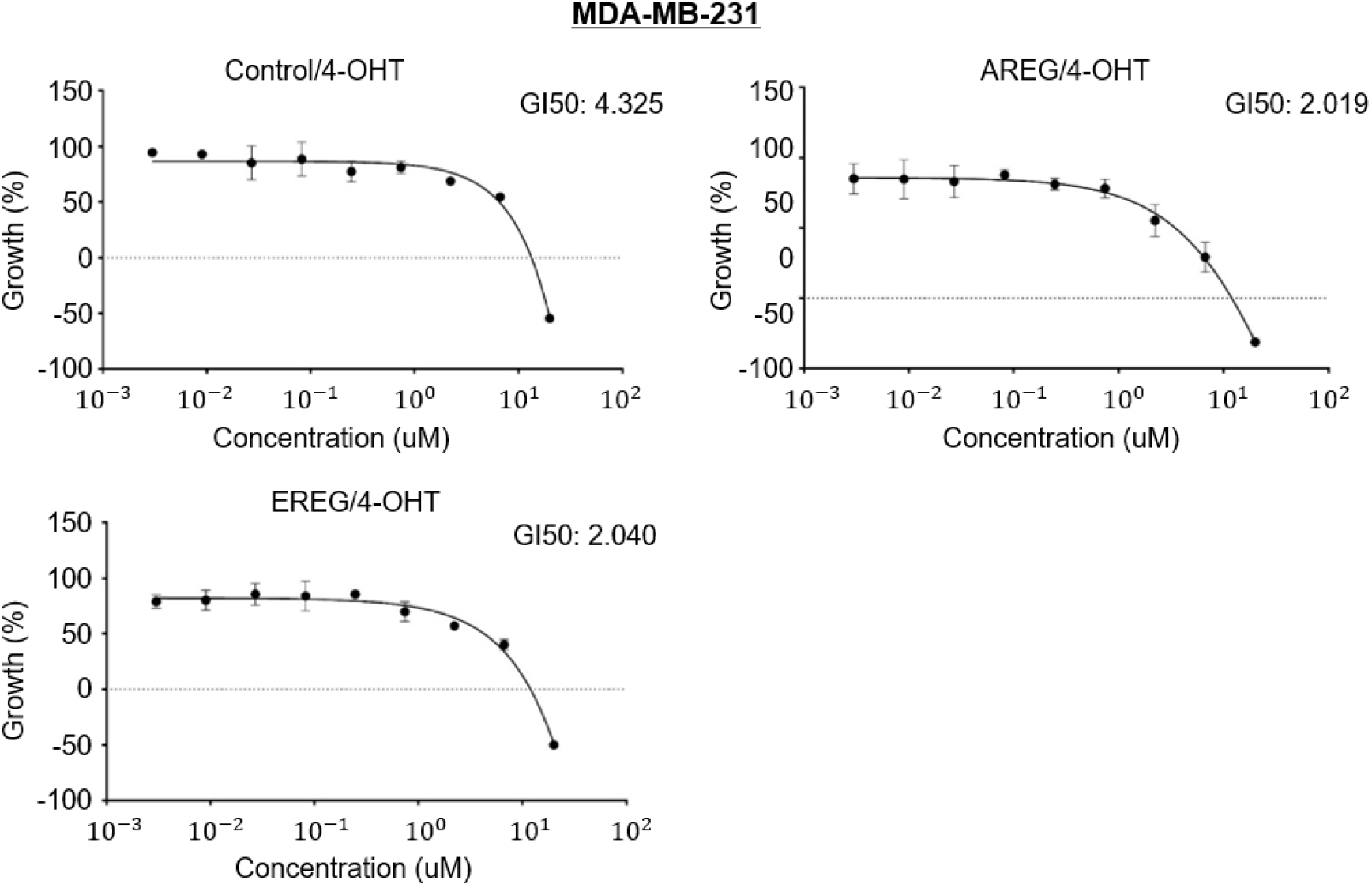
우리는 유방암세포를 더 효과적으로 사멸시키기 위해 AREG와 EREG가 억제된 세포에서 기존에 사용하던 약물처리를 통해 병용효과를 분석했다. 4-Hydroxytamoxifen(4-OHT)는 MDA-MB-231과 비교하여 ER-positive 세포인 MCF7에서 유전자 억제와의 병용효과를 분석하기 위해 사용되었다. 우리의 예상대로 MCF7에서 AREG와 EREG 그리고 4-OHT 병용처리는 약물의 민감도를 높은 수준으로 증가시켰다. Control-4-OHT에서 GI50(growth inhibiting concentration 50)은 6.084 μM, AREG-4-OHT: 1.004 μM, EREG-4-OHT: 0.6944 μM으로 나타났다(Figure 4). MDA-MB-231 세포에서 Control-4-OHT: 4.325 μM, AREG-4-OHT: 2.019 μM, EREG-4-OHT: 2.040 μM으로 나타났다(Figure 5). 이런 결과는 MCF7 세포에서 AREG 및 EREG와 4-OHT의 병용처리가 ER positive 암세포 사멸에 효과적으로 작용할 수 있음을 의미한다.
Ⅲ. 결 론
본 연구에서는 EGFR의 주요 ligand인 AREG와 EREG가 유방암 세포의 증식과 약물 내성 기전에 미치는 영향을 규명하고자 하였다. 실험 결과, AREG와 EREG는 유방암 세포주에서 특이적으로 과발현되었으며, CRISPR-Cas9를 통한 발현 억제 시 암세포의 성장이 현저히 저해됨을 확인하였다. 또한, 대표적인 호르몬 치료제인 4-OHT와의 병용 처리 시 세포주 특성에 따라 상이한 치료 효과를 나타내어, 유방암 Subtype에 따른 맞춤형 치료 전략으로서의 가능성을 제시하였다.
유방암 세포 내 AREG와 EREG의 특이적 발현 및 세포 성장의 핵심 인자로서의 역할을 규명하기 위한 western blot 분석 결과, HCT116 및 HeLa 세포주와 달리 유방암 세포주인 MCF7과 MDA-MB-231에서 AREG와 EREG가 높은 수준으로 발현됨을 확인하였다. 이것은 두 ligand가 유방암의 병리적 특성과 밀접하게 연관되어 있으며, 유방암 세포 내에서 특이적인 기능을 수행할 수 있음을 시사한다. CRISPR-Cas9 시스템을 이용하여 두 개의 유전자를 각각 knockout 시켰을 때, 두 유방암 세포주 모두에서 유의미한 성장 억제가 관찰되었다. 특히 삼중 음성 유방암 세포주인 MDA-MB-231의 경우, AREG 또는 EREG 억제 시 세포 생장률이 약 89% 이상 급격히 감소하였다. 이런 결과는 AREG와 EREG가 단순한 성장 인자를 넘어 유방암 세포, 특히 치료 옵션이 제한적인 삼중 음성 유방암의 생존과 증식 기전을 유지하는 데 필수적인 핵심 조절자 역할을 수행할 수 있음을 입증한다.
ER 양성 유방암인 MCF7에서의 4-OHT와 ligand 억제의 시너지 효과를 확인하기 위해 우리는 MCF7 세포주에서 AREG 및 EREG의 억제를 유도한 후 4-OHT를 처리하였다. MCF7에서의 병용처리는 4-OHT에 대한 약물 민감도를 높은 수준으로 증가시켰다. Control 그룹의 4-OHT GI50 값은 6.084 μM으로 나타났고 AREG 억제 시 1.004 μM, EREG 억제 시 0.6944 μM으로 감소하여 약 6∼8배 이상의 높은 효능을 보였다. 이러한 시너지 효과는 두 가지 기전으로 설명할 수 있다. 첫째, 서론에서 언급한 바와 같이 ER 양성 세포에서 에스트로겐 자극은 AREG의 발현을 유도하여 Autocrine 루프를 통해 세포 증식을 촉진한다. 따라서 4-OHT로 ER 신호를 차단함과 동시에 하위 실행 인자인 AREG 또는 EREG 자체를 제거함으로써 암세포의 생존 신호를 이중으로 차단하는 효과를 낸 것으로 예상된다. 이런 결과는 내분비 요법에 저항성을 보이는 기전을 극복하는 데 있어 EGFR ligand 표적이 효과적으로 작용할 수 있음을 시사한다.
하지만 MDA-MB-231 세포주에서는 MCF7과 다른 양상이 관찰되었다. AREG와 EREG의 단독 억제만으로도 89%라는 높은 세포 사멸 효과를 보였으나, 4-OHT와의 병용 처리에 따른 GI50 감소 폭은 MCF7에 비해 상대적으로 크지 않았다(Control: 4.325 μM vs AREG-KO: 2.019 μM, EREG-KO: 2.040 μM). 이러한 결과는 MDA-MB-231이 ER, PR, HER2가 모두 결핍된 특성에 의한 원인일 수 있다. ER이 없는 MDA-MB-231에서는 4-OHT의 주 표적인 에스트로겐 수용체 신호 전달 경로가 부재하므로, 약물 자체의 직접적인 항암 기전보다는 고농도 처리에 의한 비특이적 독성이나 미미한 부수적 효과만이 작용했을 가능성이 높다. 따라서 삼중 음성 유방암에서는 기존 호르몬 치료제와의 병용보다는, 본 연구에서 확인된 바와 같이 암세포 성장에 결정적인 역할을 하는 EREG와 AREG 자체를 표적하는 치료 전략이 더 효과적일 것으로 판단된다. EREG가 삼중 음성 유방암에서 ER과 HER2의 결핍을 보완하는 대안적 생존 신호로 작용한다는 점을 고려할 때, ligand의 차단은 난치성 유방암의 새로운 치료 바이오 마커이자 표적이 될 수 있다.
결론적으로, 본 연구는 AREG와 EREG가 유방암의 subtype에 관계없이 세포 증식에 필수적임을 규명하였으며, 특히 ER 양성 유방암에서는 호르몬 치료제와의 강력한 시너지 효과를, 삼중 음성 유방암에서는 단독 표적 치료제로서의 높은 잠재력을 확인하였다.