Ⅰ. 서 론
국내에서는 생약 원료를 이용하여 기능성식품 소재에 대한 연구가 많이 보고되어 왔고, 이러한 결과를 이용하여 천연물의약품 및 개별인정형 기능성 식품소재 및 식품의 개발에 대한 연구개발이 많이 진행되고 있다. 감초(licorice, Glycyrrhiza uralensis)는 콩과의 뿌리 및 뿌리줄기로서 그대로 또는 주피를 제거한 것으로 한방에서는 청혈해독, 윤폐지해, 보비익기, 조화제약의 효능이 있다고 알려진 ‘약방의 감초’라는 말이 나올 정도로 한약제제의 기본 생약으로 사용되고 있는 생약이다. 감초 성분은 대체로 triterpenoidal derivatives, flavone analogues, isoflavone계의 3계열로 구분되는데(1), 특히 glycyrrhizin의 항염증작용과 isoliquiritigenin의 COX(cyclooxygenase)-2와 iNOS(inducible nitric oxide synthase)의 발현억제 작용이 보고되었다(2). 감초의 함유성분 중 in vitro에서 가장 강한 항알러지 효과를 나타낸 것은 glycyrol, glycycoumarin, 18β-glycyrrhetinic acid와 liquiritigenin이었으며, in vivo에서 가장 강한 항알러지 효과를 나타낸 것은 glycyrrhizin, 18β-glycyrrhetinic acid와 liquiritigenin이었다(3). 또한, 생체 외 간세포 독성에 대한 감초 유래 성분들의 활성을 검색한 결과, glycyrrhizin, glycyrrhizinic acid 및 liquiritigenin이 우수한 간세포 보호 활성을 나타내었으며(4), 이중 glycyrrhizin이 CCl4로 유도된 급성 간독성 동물실험에서 우수한 간 보호작용을 나타내었다(5). 그러나 이러한 생리활성을 가진 저분자 성분과는 달리 감초의 다당류, 단백다당류 등의 고분자와 관련된 면역활성의 체계적인 보고는 미미한 실정이고, 재배지에 따른 감초의 생리활성 물질에 대한 품질평가 또한 국내·외적으로 보고가 전무하여 한약재 또는 식품소재로서의 감초에 대한 표준화가 시급한 실정이다. 한편, 2002년 의약분업 실시 이후에 수입량이 줄기는 했지만 여전히 우리나라에서 사용되는 감초의 90% 이상은 수입에 의존하고 있으며, 특히 대부분은 중국과 최근 우즈베키스탄 등에서 높은 수입비율을 차지하고 있는 생약이다. 또한, 일반적으로 한약제제의 경우는 정제수로 추출하나, 이러한 한약제제 원료에 대하여 정제수에서는 추출되지 않는 많은 유용한 성분을 찾아내기 위하여 주정 등의 많은 용매를 사용하여 추출하는 것이 일반적이다.
따라서 본 연구에서는 현대인의 심각한 대사질환을 해결하기 위한 중요한 수단 중 하나로 알려진 면역활성에 효과적인 생약의 식품소재를 발굴하고 대식세포 활성의 검증을 위해 국내·외 재배 감초의 열수추출물과 주정추출물을 분리, 추출하여 이들이 면역세포의 활성에 미치는 영향을 검토하기 위하여 대식세포의 활성을 측정함으로써 향후 생약 원료를 이용한 기능성 식품소재, 화장품 소재 및 천연물의약품 개발에 있어서 보다 체계적이고 안정적인 활성 데이터베이스 구축에 유용할 뿐 아니라 이들 원료를 이용하는 소비자 및 산업체의 이용에 중요한 정보를 제공하리라 판단된다.
본 실험에 사용한 감초는 2018년 9월 청주시장에서 한약규격품으로 구입한 국내산(Jecheon, Korea)과 수입산 2종(China & Uzbekistan)의 건조품을 각각 지원받아 본 실험에 사용하였다. 시료의 균질성을 위하여 소포장된 팩에서 각각 100 g씩 취하고, 한 곳에 모아 혼합한 후 분쇄기(Bazzatra, Gyeonggi-do, Korea)를 사용하여 분쇄하였다. 분쇄한 시료는 소분하여 −70°C의 급속냉동기에 보관하여 품질 저하를 방지하면서 실험에 사용하였다. 세포의 독성 및 증식활성에 사용된 Ez-cytox는 DoGenBio Co., Ltd.(Seoul, Korea)에서, 동물세포 배양 및 사이토카인 측정에 사용된 RPMI-1640 및 DMEM 배지, fetal bovine serum(FBS), penicillin과 streptomycin은 GenDepot (Katy, TX, USA)사에서 구입하였다. 한편, 면역활성 실험의 유용성을 평가하기 위해 사용된 endotoxin은 Escherichia coli O127:B8 유래 lipopolysaccharide(LPS)를 Sigma-Aldrich(St. Louis, MO, USA)로부터 구입하여 사용하였다.
분쇄기를 이용하여 일정크기로 분쇄한 건조한 감초(제천산, 중국산 및 우즈베키스탄산)를 환류 플라스크에 넣고 95% 주정을 5배(w/v) 첨가한 후 환류관에 연결하여 2시간 동안 처리(50~60°C, 3회)하고 여과액을 모두 모아 농축한 후 원심분리(9,000×g, 5°C, 30분)로 얻은 상등액을 동결건조하여 주정추출물(ethanol extract, E)을 조제하였다. 또한 분쇄한 감초에 20배(w/v)의 증류수를 첨가하고, decoction 방법으로 처리(90~95°C, 3회)한 후 여과액을 모아 농축 및 원심분리하고 상등액을 열수추출물(hot-water extract, HW)로 동결건조하였다.
국내·외 재배 3종 감초로부터 추출된 열수와 주정추출물의 대식세포(macrophage) 활성화를 검토하기 위하여 Raw 264.7 대식세포주를 한국세포주은행(Seoul, Korea)에서 구입하여 RPMI-1640 배지에 수회 계대배양하여 활성화한 후 실험을 위해 1.0 × 106 cells/mL가 되도록 배양하여 분산시켰다. 세포 분산액은 96-well plate의 각 well에 200 μL씩 분주한 후 37°C, 5% CO2 배양기에서 2시간 동안 배양하고, 각 well plate 기벽에 부착시켜 대식세포 monolayer를 형성시켰다(6). 2시간 후 미부착 세포는 제거하고 10% FBS-함유 RPMI-1640 배지를 각 well에 180 μL씩 분주한 후 일정 농도의 시료 20 μL를 가하여 5% CO2 배양기에서 37°C로 24시간 배양하여 대식세포를 자극하였다. 시료의 대식세포 활성화 정도는 시료의 자극에 따라 활성화된 대식세포로부터 배양액에 생산되는 사이토카인(tumor necrosis factor-α, interleukin-6와 IL-12)과 nitric oxide(NO) 생산능으로 확인하였는데, 세포배양 상등액 50 μL를 취하여 BD Bioscience(East Rutherford, NJ, USA)사 매뉴얼에 따라 ELISA법으로 측정하고, NO는 Griesse 시약을 이용하여 표준물질의 검량곡선으로부터 그 양을 산출하였다. 한편, 감초 용매추출물의 Raw 264.7의 대식세포주에 대한 독성 여부는 시료와의 배양 후 Ez-Cytox kit(7)를 이용하여 세포 생존율을 측정하고 saline 대조군과 비교하여 확인하였다.
병원미생물을 포함한 외부 물질의 침입과 정상세포의 변형을 감지하여 신체를 보호하는 림프계는 대식세포와 보체계 등의 선천면역과 림프구에 의해 조절되는 후천면역계로 구분되는데, 대식세포(macrophage)는 선천면역계에서 가장 중요한 역할을 수행하는 면역세포로, 이들이 활성화되면 탐식작용, 항원-항체복합체 제거 및 선천면역계 조절작용 등으로 생체 면역증진에 중요하게 관여할 뿐만 아니라, 활성산소종 및 산화질소(nitric oxide, NO) 등의 생산을 증가시켜 외부에서 침입한 병원체 및 항원을 제거하며(8, 9), 대식세포는 항원제시세포로 작용하여 항원 특이적인 후천면역계를 유도하게 된다(10). 따라서 국내·외 재배 3종 감초의 용매추출물이 선천면역계를 자극할 수 있는지를 알아보기 위하여 시료의 대식세포의 활성화에 따라 생산되는 면역촉진 사이토카인의 생산을 검토하였다. 먼저, 활성측정을 위한 적절한 시료량 검토를 위하여 시료에 대한 대식세포의 독성을 측정한 결과(Table 1), 제천산 및 수입산 2종 모두 주정추출물에서도 20과 100 μg/mL의 모든 농도에서 독성을 거의 나타내지 않았으며(saline 대조군의 0.99~1.22배), 오히려 열수추출물에서는 20 μg/mL의 저농도에서도 대식세포의 증식효과(제천산/KJ-HW; saline 대조군 1.45배, 외산; C-HW 1.52와 U-HW 1.62배)를 보였고, 100 μg/mL에서는 제천산에서 2.09배까지 증식되어 양성대조군으로 사용된 LPS보다도 높은 대식세포의 증식을 자극하였다. 따라서 대식세포 활성화 실험은 20과 100 μg/mL의 시료농도에서 측정하였다.
먼저, NO는 활성화된 대식세포의 inducible nitric oxide synthetase(iNOS)에 의하여 L-arginine으로부터 다량으로 합성되어(11), 세균 침입을 억제하거나 T세포 증식을 억제하여 과도한 국소 염증반응을 하향시키는 방어에 중요한 역할을 하고 있는 것으로 보고되고 있다(12). 따라서 NO 생성에 대한 국내·외 재배 3종 감초 용매추출물의 생성효과를 조사한 결과(Figure 1), 주정추출물(E)은 20 μg/mL의 저농도뿐만 아니라, 100 μg/mL의 고농도에서도 saline 대조군(2.6 μM)과 비교하여 거의 NO 생산에 효과를 나타내지 않아(2.5~2.9 μM) 저분자가 주성분인 주정추출물은 대식세포의 활성을 자극하지 못하는 것으로 확인되었다. 그러나 열수추출물(HW)의 경우에는 20 μg/mL에서도 제천산(KJ-HW, 4.3 μM)이 saline 대조군보다 1.6배 정도 생산이 촉진되었고, 100 μg/mL의 고농도에서는 KJ-HW이 16.4 μM로 가장 높은 NO 생산을 나타내었고 외산의 경우에도 8.3~10.3 μM로 saline 대조군보다 NO 생산을 촉진되어 감초의 열수추출물이 대식세포를 활성화시키고 있음을 알 수 있었다. 따라서 중국과 우즈베키스탄의 감초보다는 국내 제천산 감초의 대식세포 활성화 효과가 높은 것으로 확인되었다. 한편, 활성화된 대식세포는 interleukin(IL)-1, IL-6 및 tumor necrosis factor (TNF)-α와 같은 다양한 사이토카인을 분비하여 후천면역계를 활성화시킨다(13). 인체의 대표적 면역세포인 대식세포가 활성화되면 외부로부터 침입한 세균 및 이물질을 제거하기 위해 NO, ROS(radical oxygen species)와 같은 chemokine 및 다양한 사이토카인을 분비하게 된다(9). 또한, 활성화된 대식세포에 의해 분비된 다양한 사이토카인은 다른 면역세포의 기능조절과 신호전달에 중요한 역할을 하는 용해성 단백질로 면역세포간의 복잡한 사이토카인 네트워크를 형성하여 면역계 전체의 반응 및 효율화에 공헌한다고 알려져 있다(14). 따라서 시료로 자극된 대식세포로부터 생산되는 사이토카인 중 TNF-α 생산에서는 제천산 열수추출물 100 μg/mL(KJ-HW, 3,982 pg/mL)이 중국산 열수추출물(C-HW, 3,611 pg/mL)보다 1.10배 높은 가장 우수한 활성을 나타내었고, 20 μg/mL의 낮은 농도에서도 KJ-HW와 C-HW는 677 pg/mL와 711 pg/mL로 saline 대조군(166 pg/mL)보다 높은 생산능을 보였으나, 우즈베키스탄산은 이들보다는 낮은 생산성(492 pg/mL와 1,897 pg/mL)을 보였다(Figure 2). 그러나 주정추출물의 경우에는 가장 높은 KJ-E가 100 μg/mL에서 208 pg/mL 수준으로 saline 대조군보다는 높았으나, 열수추출물보다 유의적으로 훨씬 낮은 TNF-α 생산능을 나타내었다. TNF-α는 활성화된 대식세포에 의해 분비되어 면역세포를 조절하는 중요한 사이토카인으로서 변형된 세포의 자살을 유도하거나 종양 생성 및 바이러스 복제를 억제하는 능력을 갖는다(15). 또한, TNF-α는 림프구에 의해 생산되는 염증 매개성 사이토카인으로 생체 면역반응에서 단독적 혹은 IL-1 등과 복합적으로 작용하여 종양의 혈관을 손상시켜 결과적으로 종양 괴사를 유발하거나, 미생물에 의한 감염 저항성을 향상시킨다고 보고되어 있다(16, 17).
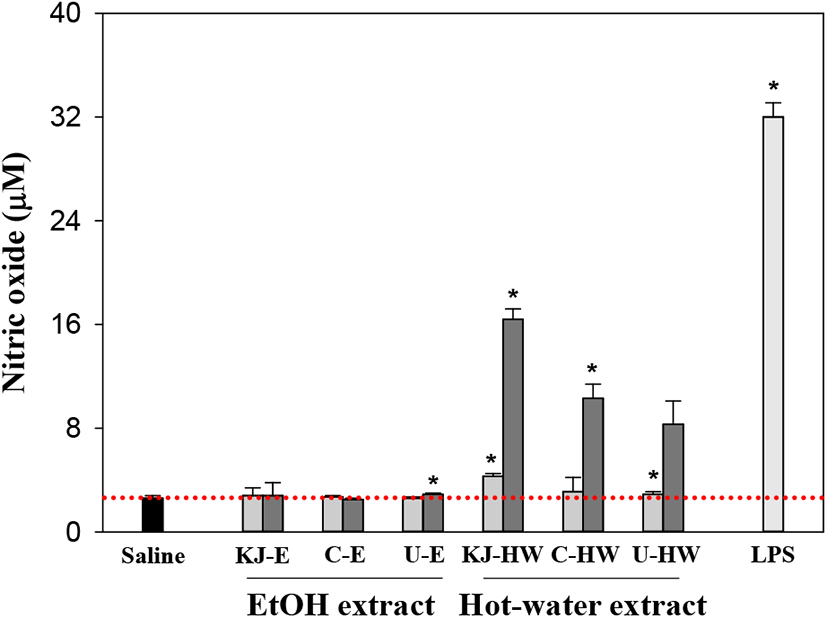
 ; 20 μg/mL,
; 20 μg/mL,  ; 100 μg/mL, LPS (1 μg/mL); lipopolysaccharide from Escherichia coli. Results are presented as mean± standard deviation of four independent experiments. * p<0.05; significant difference between the saline and each sample.
; 100 μg/mL, LPS (1 μg/mL); lipopolysaccharide from Escherichia coli. Results are presented as mean± standard deviation of four independent experiments. * p<0.05; significant difference between the saline and each sample.
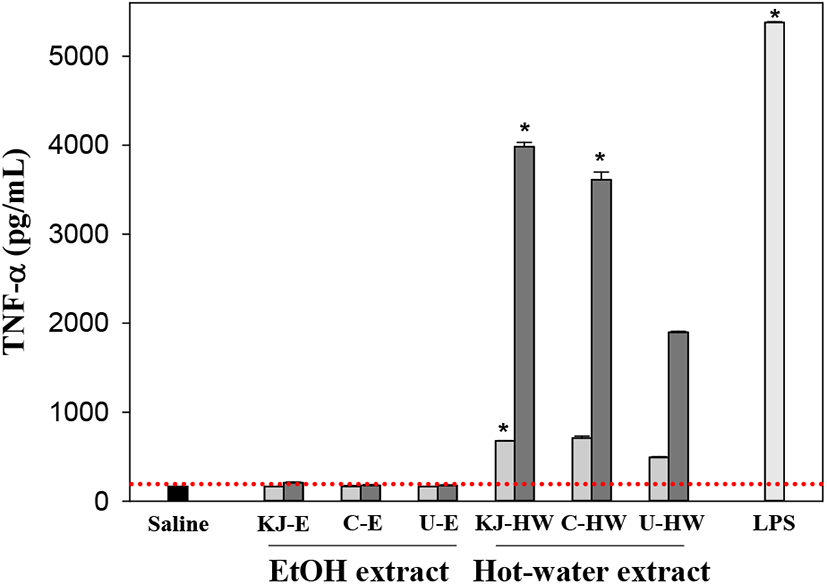
 ; 20 μg/mL,
; 20 μg/mL,  ; 100 μg/mL, LPS (1 μg/mL); lipopolysaccharide from E. coli. Results are presented as mean±standard deviation of four independent experiments. * p<0.05; significant difference between the saline and each sample.
; 100 μg/mL, LPS (1 μg/mL); lipopolysaccharide from E. coli. Results are presented as mean±standard deviation of four independent experiments. * p<0.05; significant difference between the saline and each sample.
IL-6에서도 TNF-α와 마찬가지로 열수추출물만이 유의적으로 높은 생산능을 나타내었는데 100 μg/mL 시료농도에서 제천산 KJ-HW는 920 pg/mL로 중국산 C-HW(361 pg/mL)보다 현저히 높은 생산능을 보였고 20 μg/mL의 낮은 농도에서도 KJ-HW는 231 pg/mL로 저농도에서 가장 높은 우즈베키스탄 U-HW(169 pg/mL)보다는 1.37배나 높은 IL-6 생산능을 나타내었다(Figure 3). 그러나 주정추출물에서는 saline 대조군(18.6 pg/mL)보다는 100 μg/mL의 농도에서 약간 높았으나(24~44 μg/mL), 주정에서 주로 추출되는 폴리페놀이나 플라보노이드 등의 저분자 물질은 대식세포로의 자극에 따른 IL-6 생산에 관여하지 않는 것을 확인할 수 있었다. IL-6도 활성화된 대식세포로부터 분비되어 B 세포 계열의 증식과 항체 분비 등의 획득면역에 조절작용을 나타내는 대표적인 사이토카인이다(18). 또한, IL-6는 감염과 조직 손상에 따른 면역 초기반응에서 생산되는 주요한 반응 매개물질로 IL-1, TNF-α 등에 의해 IL-6의 유전자 발현이 자극되어 단핵세포, 대식세포, 간질세포 등에 의해 생산되고, 급성염증반응을 촉진 또는 억제하는 것으로 알려져 있다(19, 20).
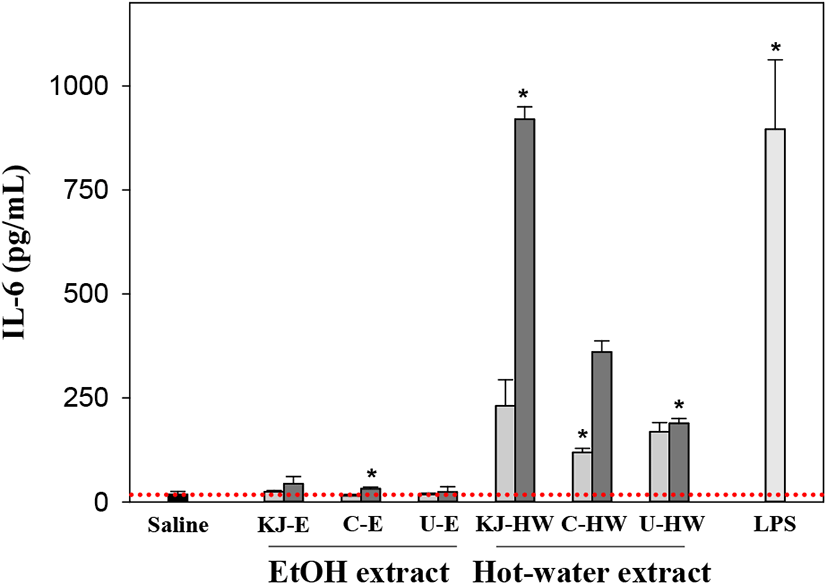
 ; 20 μg/mL,
; 20 μg/mL,  ; 100 μg/mL, LPS (1 μg/mL); lipopolysaccharide from E. coli. Results are presented as mean±standard deviation of four independent experiments. * p<0.05; significant difference between the saline and each sample.
; 100 μg/mL, LPS (1 μg/mL); lipopolysaccharide from E. coli. Results are presented as mean±standard deviation of four independent experiments. * p<0.05; significant difference between the saline and each sample.
마지막으로 활성화된 대식세포로부터 분비되는 자연살해세포(natural killer cell, NK)와 보조 T세포의 성숙 및 분화촉진에 관련된 사이토카인인(21) IL-12 생산에서는 TNF-α 및 IL-6 생산과는 달리 열수추출물 100 μg/mL 농도에서도 81 pg/mL(KJ-HW)로 가장 높았으나 saline 대조군(69 pg/mL)과 큰 차이를 보이지 않았을 뿐만 아니라 20 μg/mL의 낮은 농도에서는 saline 대조군과 거의 유사하였다(Figure 4). 또한, 주정추출물 경우에도 saline 대조군과 거의 유사한 생산성으로 매우 낮은 수준임이 확인되었다.
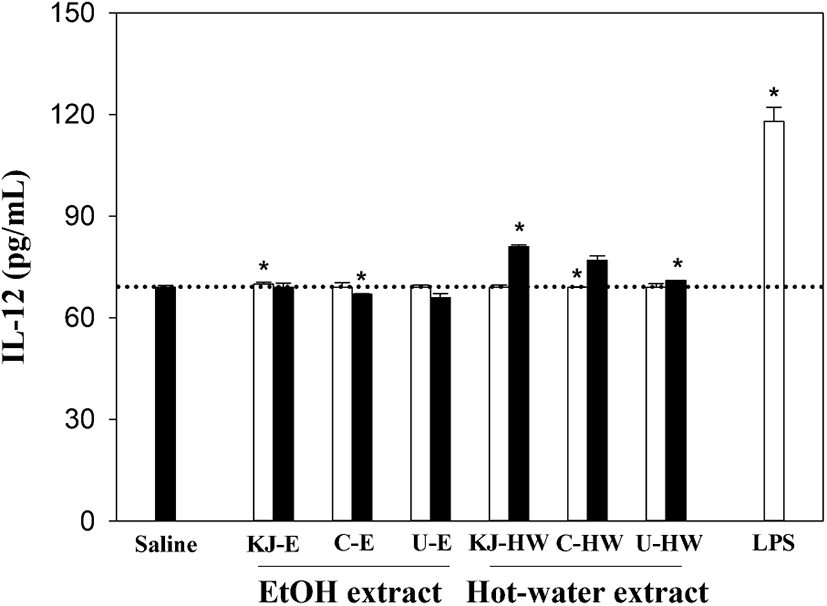
 ; 20 μg/mL,
; 20 μg/mL,  ; 100 μg/mL, LPS (1 μg/mL); lipopolysaccharide from E. coli. Results are presented as mean±standard deviation of four independent experiments. * p<0.05; significant difference between the saline and each sample.
; 100 μg/mL, LPS (1 μg/mL); lipopolysaccharide from E. coli. Results are presented as mean±standard deviation of four independent experiments. * p<0.05; significant difference between the saline and each sample.
결론적으로 국내·외 재배 3종 감초의 용매추출물에 대한 대식세포 활성을 검증한 결과, 20 μg/mL와 100 μg/mL의 시료농도에서 Raw 264.7 대시세포주에 대하여 독성을 보이지 않았고 감초의 열수추출물의 활성이 우수한 반면, 주정추출물은 거의 활성을 나타내지 않았다. 특히, 열수추출물 중 제천산 감초(KJ-HW)가 활성화된 대식세포에서 생산되는 NO뿐만 아니라 TNF-α와 IL-6 등의 사이토카인 생산을 중국과 우즈베키스탄의 수입산 보다 더욱 자극함을 확인하여 선천면역계의 활성화에 작용할 수 있음을 제시함으로써 감초 열수추출물의 기능성식품 소재로의 활용에 가능성을 확인할 수 있었다.
Ⅳ. 결 론
감초의 생리활성 물질의 기능성, 품질평가 및 표준화를 위해 국내·외 재배 3종(제천산, 중국산과 우즈베키스탄산) 감초의 열수 및 에탄올 추출물을 제조하고 그들의 면역활성을 비교하였다. 대식세포에 의한 면역활성에서 제천산 감초의 열수추출물(KJ-HW)은 TNF-α(시료농도 100 μg/mL에서 3,982 pg/mL) 및 IL-6(920 pg/mL)와 같은 대식세포 활성화 관련 사이토카인의 생성을 중국산(C-HW; 3,611 pg/mL와 361 pg/mL) 또는 우즈베키스탄산(U-HW; 1,897 pg/mL와 189 pg/mL) 보다 더 강하게 자극하였다. 또한, KJ-HW에 의해 자극된 대식세포로부터의 산화질소 생성(16.4 μM)은 C-HW(10.3 μM) 또는 U-HW(8.3 μM)보다 높았다. 그러나 모든 주정추출물은 대식세포 활성이 유의적으로 나타나지 않았다. 결론적으로 제천산 감초는 중국산 및 우즈베키스탄산 감초보다 면역활성이 더 강하여 기능성 식품소재로 활용될 수 있는 가능성을 제시하였다.
