Ⅰ. 서 론
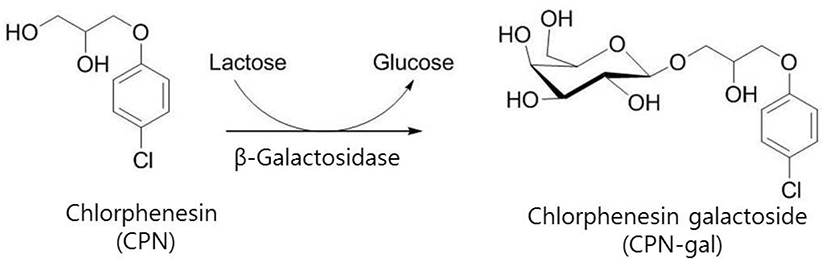
화장품의 방부제로 사용되어지고 있는 chlorphenesin(CPN)은 인체 피부에 문제를 유발할 가능이 꾸준히 제기되어 왔다(1, 2). 이에 대하여 본 연구팀에서는 갈락토오즈 한 분자를 CPN에 결합시킨 chlorphenesin galactoside(CPN-gal)를 합성하여, CPN을 대체할 수 있는 방부제로 사용할 수 있는지에 대하여 그 동안 연구를 수행하여 왔다(3, 4). 본 연구팀이 제시한 CPN-gal을 합성하는 방법은 대장균(Escherichia coli, E. coli)의 β-galactosidase(β-gal)를 이용하여 transgalactosylation 반응으로 CPN의 galactoside를 만드는 방법이었다(Figure 1). 본 연구팀의 결과에 의하면, 합성된 CPN-gal은 인간 피부세포에 독성을 현저하게 감소시키는 것으로 관찰되었으며(3), 이러한 장점 때문에 화장품 방부제 galactoside 유도체의 실용화를 위한 제조공정 및 정제공정 관련 연구를 수행하여 왔다(5, 6). 산업화를 위하여서는 효율적인 분리/정제시스템의 확립도 매우 중요하며, 또한 대량 생산을 위한 경제적인 합성시스템의 운전방법의 확립이 매우 중요하다. 본 연구에서는 이러한 경제적인 합성시스템의 확립을 위하여 연속적인 CPN-gal의 합성을 위한 운전방법에 대하여 연구를 수행하였다. 그 중에서도 repeated-batch 운전방법을 근간으로 하는 CPN-gal 합성을 위한 두 가지 운전방법에 대한 연구를 수행하였다. 첫 번째 연구에서는 연속적인 repeated-batch 과정에서 CPN, lactose, β-gal 중 어떤 것은 보충해주고, 어떤 것은 보충해주지 말아야 할지를 결정하는 연구였으며, 두 번째 연구에서는 β-gal을 함유하고 있는 E. coli 세포를 Celite(diatomaceous earth)에 흡착 고정화시켜서, 이를 연속적인 repeated-batch 운전에 사용하는 연구를 수행하였다. 이러한 연구를 통하여 개발된 장기간에 걸친 연속 CPN-gal 합성법이 CPN-gal의 경제적인 생산에 긍정적인 효과를 줄 것으로 기대하고 있다.
II. 재료 및 방법
Chlorphenesin(CPN)은 CosMol(Siheung, Korea)에서 구입하였고, TLC(thin-layer chromatography) plate는 Macherey-Nagel(Düren, Germany)의 DC-Fertigplatten SIL G-25 UV254를 사용하였다. Celite는 대정화학의 Celite 545를 사용하였다. 기타 본 연구에 사용한 시약들은 reagent-grade를 사용하였다.
E. coli의 araBAD 프로모터 시스템에 의하여 발현이 조절되는 pBAD/Myc-His/lacZ vector(7.2 kb)(Invitrogen, Carlsbad, CA, USA)를 사용하여 E. coli MC1061를 발현 숙주로 하여 β-gal을 발현하였고, 발효조를 이용하여 β-gal이 발현된 E. coli의 생산에 대하여는 선행 연구에서 자세히 설명하였다(7, 8).
50 mL conical tube에 50 mM phosphate buffer를 이용하여, 400 g/L lactose, 14.4 U/mL β-gal(E. coli cell을 사용), 그리고 39.5 mM CPN를 녹인다. 이 때, pH를 7.0으로 조절하고, 전체 부피를 40 mL 되게 한다. 그리고 shaking incubator에서 40°C, 100 rpm 조건에서 반응시켰다. 합성 최적조건에 대하여서는 지난 연구에서 상세히 설명하였다(9). Repeatedbatch 방법으로 합성을 진행하기 위하여 24시간 동안 반응이 끝난 후, 50 mL conical tube를 방치하여 반응물의 상등액을 회수하고, 다음 반응에 필요한 CPN과 lactose 혹은 β-gal 함유 세포를 넣고, 다시 24시간 반응을 수행하였다. 이러한 방법을 반복하면서, 연속적인 repeated-batch 운전을 계속 수행하였다. Celite에 세포를 흡착하여 사용하는 경우에는 14.4 U/mL β-gal이 흡착된 Celite를 사용하는 것 이외에는 같은 방법으로 연속적인 repeated-batch 운전을 계속 실시하였다.
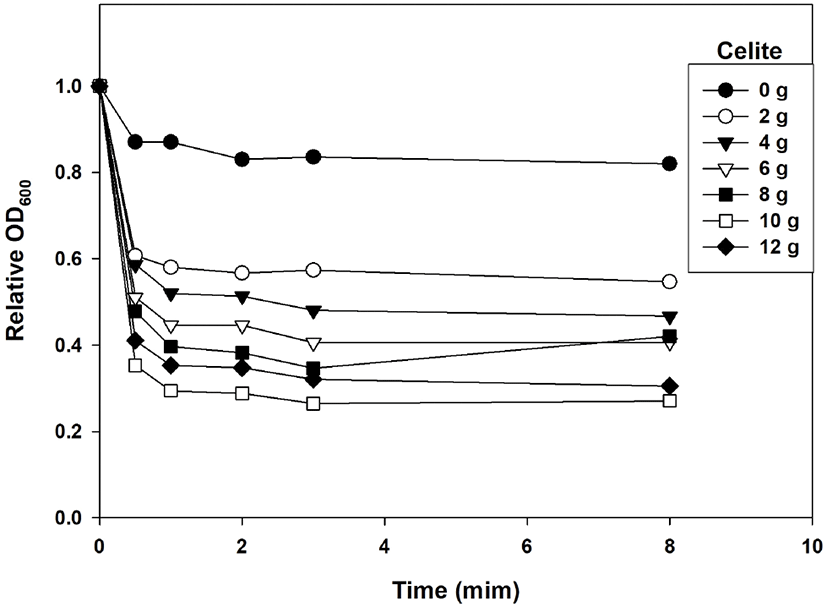
50 mL conical tube에 optical density (at 600 nm)가 1.0 정도인 E. coli MC1061 배양 30 mL를 넣는다. 그리고 Celite를 2 g, 4 g, 6 g, 8 g, 10 g, 12 g 넣고 방치한 후, 상등액을 취하여 turbidity를 측정하여 세포와 함께 침전하는 Celite의 비율을 계산하였다.
20 × 10 cm TLC(thin-layer chromatography) plate에 1.0 μL 시료를 loading하고, acetonitrile:water = 85:15(v/v)을 이동상으로 하여 15분 전개하였다. 그리고 staining solution(1.25 g KMnO4, 10 g K2CO3, 1.25 mL 10% NaOH in 200 mL water)를 TLC plate에 뿌린 후, 80°C oven에서 15분간 말려서 CPN과 CPN-gal의 spot을 확인하였다. 정량 분석을 위하여 TLC plate를 스캔하여 이미지를 얻은 후, AlphaEase FC software (Alpha Innotech, San Leonardo, CA, USA)를 이용하여 CPN과 CPN-gal의 양을 분석하였다. CPN-gal 정량은 CPN으로부터 CPN-gal로의 전환이 1:1로 이루어진다는 가정하에 CPN의 감소량으로부터 CPN-gal 양을 계산하였다. 그리고, CPN으로부터 CPN-gal로의 전환수율(conversion %)은 반응 시작할 때, 넣은 39.5 mM CPN에서 합성된 CPN-gal의 비율에서부터 계산하여 구하였다.
III. 결과 및 고찰
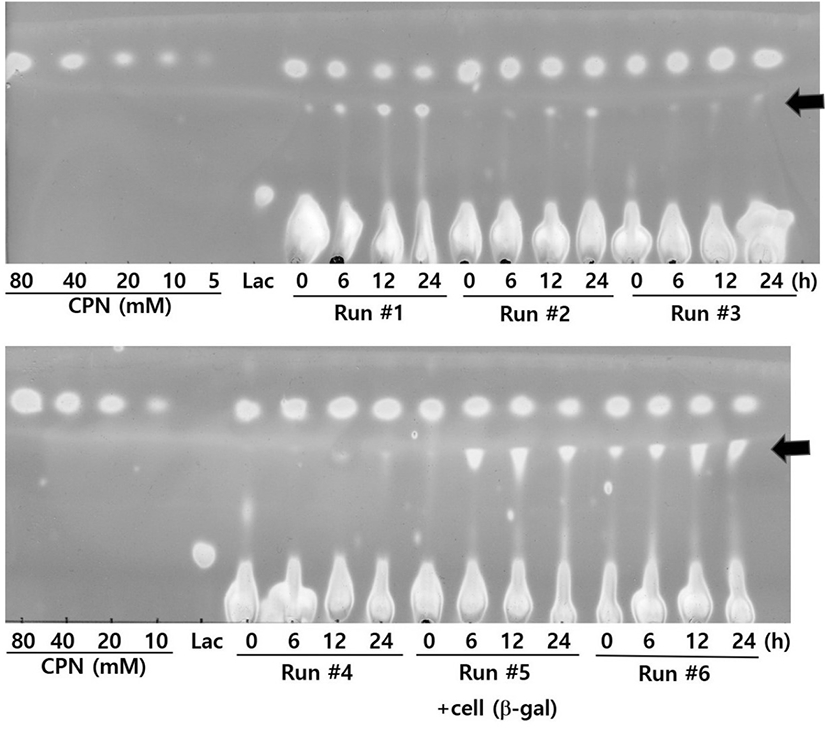
연속적이고 장기간에 걸쳐서 CPN(39.5 mM)로부터 CPN-gal을 합성하기 위하여, 아래 Figure 2와 같이 CPN-gal 합성 조건에서 24시간 동안 합성반응을 수행한 후(Run #1), CPN과 lactose를 다시 보충하고, 두 번째(Run #2) 24시간, 세 번째(Run #3) 24시간 합성반응을 연속으로 이어서 수행하였다. 이 때, β-gal을 함유하고 있는 E. coli은 보충하지 않았다. CPN-gal의 합성이 두 번째 합성반응부터 감소하기 시작하였다. 이러한 현상은 아마도 β-gal이 합성 조건에서 오랫동안 활성을 유지하지 못해서 일어나는 현상으로 이해되었다. 그래서 중간에 β-gal을 보충하여 연속적으로 합성을 진행하기로 하였다.

중간에 β-gal을 보충하는 것이 CPN-gal 합성에 어떠한 영향을 미치는 지를 확인하기 위하여, Figure 3과 같이 다섯 번째 합성 시작할 때, β-gal(14.4 U/mL) 첨가해 주었다. 그 결과, CPN-gal의 합성이 다시 시작되는 것으로 확인되었다. 이로 인해서 합성은 여섯 번째 합성에서도 계속 이어졌다.
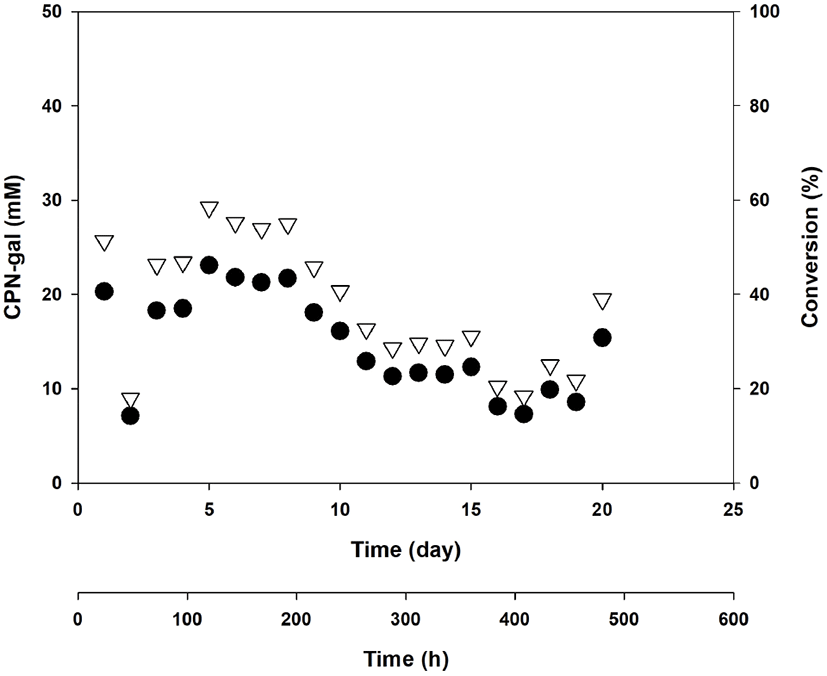
그래서 이러한 연속 repeated-batch 운전을 계속 진행하기 위하여 합성이 시작된 후, 짝수 batch마다 β-gal(14.4 U/mL)을 첨가하여 효소 활성을 유지해주기로 하였다. Figure 4는 이러한 β-gal의 보충을 통하여 효소 활성이 유지된 경우이며, 적어도 CPN-gal의 합성이 멈추지는 않고 계속 운전할 수 있었다. 이러한 전략으로 매 batch마다 CPN과 lactose는 보충해 주고, 짝수 batch마다 β-gal을 보충해 주는 방법으로 20번(20 × 24시간 = 480시간)의 연속적이고 반복적인 batch 운전법으로 CPN-gal의 합성을 진행할 수 있었다(Figure 5). 480 시간 20번의 repeated-batch 운전에서 Figure 5에서 볼 수 있듯이 약 열 번째 정도까지 만 39.5 mM CPN으로부터 약 16~20 mM CPN-gal이 합성되었고, CPN으로부터 CPNgal로의 conversion 수율은 약 40~50% 정도였다. 그러나 이후에는 10% 이하의 conversion 수율을 보여 주었다. 즉, 240시간 10회 정도까지는 우리가 원하는 수율을 보여주었으나, 그 이후에는 낮은 수율로 합성이 이루어졌다. 이에 대한 여러 가지 추정 가능한 이유가 있을 수 있겠으나, 반응물에 남아있는 galactose에 의한 product inhibition에 의하여 합성 반응이 원활이 이루어지지 못했던 것으로 추론되며, 이 현상은 본 연구팀에서 이전 연구에서 확인했었다(10). 또 한 가지는 반응이 진행되면서, 계속해서 녹지 않는 lactose의 양이 점진적으로 증가하여 발생하는 문제점으로 아마도 과량의 lactose 측적이 합성반응을 방해했을 것으로 추론되어진다.
두 번째의 연속적인 CPN-gal 합성방법은 β-gal을 함유하는 E. coli 세포를 Celite에 흡착 고정화시켜서 연속적인 합성에 사용하는 방법이다. 그래서 먼저 Celite와 E. coli 세포와의 흡착에 대하여 조사하여 보았다. 이 때 β-gal을 생산하는 E. coli 세포의 host cell인 E. coli MC1061과 Celite와의 흡착실험을 수행하였다. Figure 6은 Celite 양에 따른 Celite와 E. coli 세포의 흡착실험 결과를 보여주고 있다. Celite와 세포를 섞은 후, 방치하여 상등액의 optical density를 측정하였는데, Figure 6과 같이 Celite와 세포가 함께 침전하여 optical density 값의 감소가 관찰되었다. Celite의 첨가량이 많으면 상대적으로 감소폭이 커지는 경향이 있었으나, 참고문헌 들(11, 12)의 결과를 고려하여, 세포배양액(optical density, 약 1.0) 30 mL에 8~12 g의 Celite를 섞어서 세포를 Celite에 흡착시키는 것으로 결정하였다. 그래서 repeatedbatch 실험에 사용하는 β-gal이 흡착된 Celite는 세포배양액(optical density, 약 1.0) 30 mL에 8 g의 Celite를 혼합하여 세포를 흡착시켜서 만들어 사용하였다.
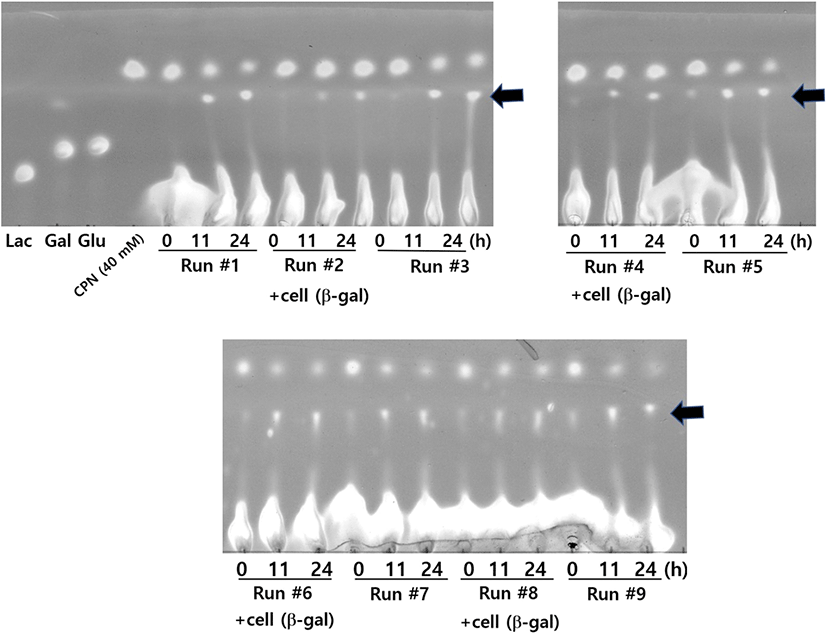
Figure 6의 방법으로 Celite에 E. coli 세포를 흡착 고정화 시키고, 이를 이용하여 연속적인 repeated-batch 운전을 수행하여 39.5 mM CPN으로부터 CPN-gal 합성을 실시하였다. CPN과 lactose를 넣고, β-gal (14.4 U/mL)을 함유하는 E. coli 세포를 흡착시킨 Celite를 넣었다. 연속적인 repeated-batch 운전 중에 CPN과 lactose은 매번 넣어 주었으나, E. coli 세포를 흡착시킨 Celite는 첫 번째 batch 운전에서 한 번만 넣고, 이후로는 넣지 않았다. Figure 7의 TLC 결과는 적어도 12회 batch 운전까지 CPN-gal이 합성되고 있는 것을 보여주고 있다. 이와 같은 repeated-batch 운전을 20번(20 × 24시간 = 480시간) 연속적이고 반복적으로 운전하여 CPN-gal의 합성량을 표시한 결과가 Figure 8이다. Figure 8의 결과를 보면 39.5 mM CPN으로부터 40~70% 수율로 약 45~73 mM CPN-gal이 16번째 운전(384시간)까지 합성되었으며, 그 이후로는 10% 이하의 낮은 CPN-gal 합성 수율을 보여주고 있다.

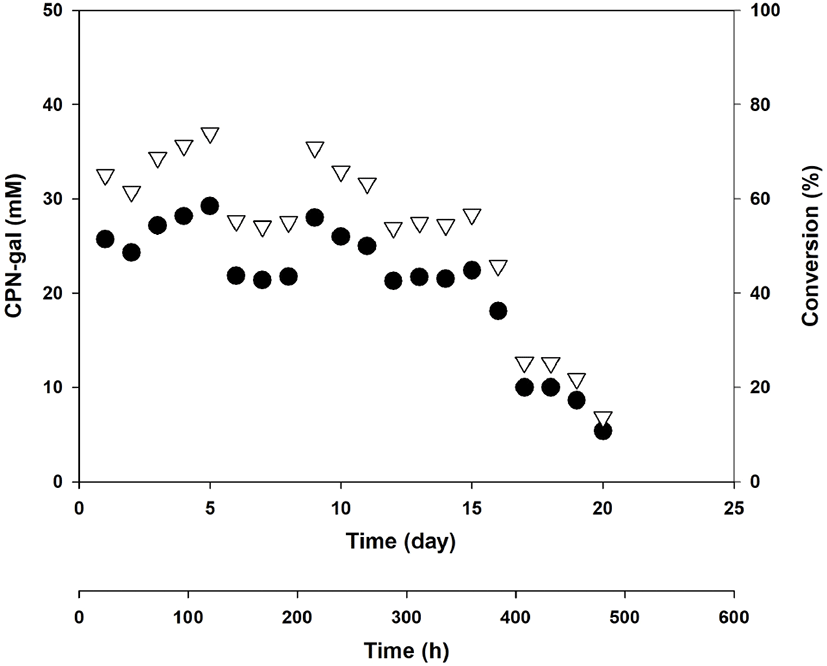
Figure 4와 Figure 5에서와 같이 Figure 7과 Figure 8의 결과에서도 후반부에 CPN-gal 합성이 감소되는 현상이 관찰되었는데, 이러한 현상도 Figure 4와 Figure 5에서 발생하는 감소현상과 그 이유와 유사할 것으로 추론되며, 다만 Celite에 세포가 흡착되어 있어서, 그 현상이 좀 지연되어 나타나는 것만 다르게 관찰되었다.
Figure 5와 Figure 8을 비교하면, 가장 큰 차이는 E. coli cell을 Ceilite에 흡착시켜 사용하였는지에 있다. Figure 8에서는 Celite에 세포가 붙어 있어서 처음에 합성반응을 시작할 때, 한번 세포가 붙어있는 Celite를 첨가하고, 그 후로는 전혀 첨가하지 않았다. 두 결과를 비교하여 보면, Figure 8과 같이 Celite에 세포를 흡착하여 한번 첨가하여 사용한 경우가 더 오랫동안 CPN-gal을 합성하는 결과를 보여 주었다. 이 경우에는 추가적으로 세포를 첨가해 주어야 했던 Figure 5의 경우보다 운전상에 더 큰 장점을 가지고 있다고 할 수 있다. 즉, 세포 안의 효소를 더 경제적으로 사용할 수 있다는 점이 있고, 흡착된 세포 안의 효소를 한 번만 넣어주면 상대적으로 오랫동안 CPN-gal 합성에 사용할 수 있다는 것을 보여주고 있다. Celite에 흡착된 세포 안의 효소가 합성반응 조건에서 더 오랫동안 안정되게 견딜 수 있는 환경에 처해 있는 것으로 생각되어진다. 아마도 이러한 이유로 적어도 16번째 운전(384시간)까지 CPN-gal 합성이 적어도 약 40% 이상의 conversion 수율로 진행된 것으로 생각되어진다. 추론해보면, Celite에 흡착된 β-gal 함유 세포를 이용하여 합성하는 것이 Figure 4와 Figure 5에서 추가적으로 세포를 공급하여 합성을 진행해야 했던 문제를 극복할 수 있는 새로운 대안으로 생각되어진다.
IV. 결 론
본 연구에서는 repeated-batch 방법을 근간으로 하는 CPN-gal 합성을 위한 연속 운전방법에 대한 연구를 수행하였다. 첫 번째 연속적으로 24시간마다 CPN과 lactose를 첨가 해주고, 짝수 batch마다 β-gal 함유 세포를 첨가하는 방법으로 운전한 경우에는 480시간 20번의 repeated-batch 운전에서 약 열 번째 정도까지 39.5 mM CPN으로부터 열 번째 운전까지 약 40~50%의 약 16~20 mM CPN-gal로의 conversion 수율을 보여 주었고, 그 이후에는 약 10% 이하의 낮은 수율이 관찰되었다. 두 번째 방법으로는 Celite에 β-gal 함유 E. coli 세포를 흡착 고정화시키고, 이를 이용하여 repeated-batch 운전에 사용하는 방법으로 CPN으로부터 CPN-gal 합성을 실시하였다. CPN과 lactose를 넣고, E. coli 세포를 흡착시킨 Celite를 넣었으며, 연속적인 repeated-batch 운전 중에 CPN과 lactose은 매번 넣어 주었으나, E. coli 세포를 흡착시킨 Celite는 첫 번째 batch 운전에서 한 번만 넣어주었으며, 이후로는 넣지 않았다. 이와 같은 repeated-batch 운전을 20번(480시간) 연속적이고 반복적으로 운전하였으며, 39.5 mM CPN으로부터 약 40~70% 수율로 약 45~73 mM CPN-gal이 16번째 운전(384시간)까지 합성되었다. 그러나, 이후에 이 경우에도 역시 약 10% 이하의 낮은 합성 수율이 관찰되었다. 이러한 연구 수행을 통하여 장기간에 걸친 연속 CPN-gal 합성을 위한 운전법의 특성을 확인/분석할 수 있었고, 앞으로 CPN-gal의 경제적인 생산 공정 개발에 기초적인 지식을 제공하고, 상업적인 CPN-gal 생산에 긍정적인 효과를 줄 것으로 기대하고 있다.