Ⅰ. 서 론
인간은 미생물을 제어하기 위해 항생제를 사용해 왔으며, 가축, 양식어류 등에 감염 치료 및 예방뿐만 아니라, 성장 촉진을 위한 항생제 오남용을 해왔다. 항생제를 무분별하게 사용함에 따라 미생물은 항생제에 대한 저항력을 갖도록 변이해 왔으며, 여러 항생제에 내성이 있는 슈퍼박테리아(superbacteria)가 출현하면서 기존의 항생제 치료가 어려워져 심각한 문제가 되고 있다(1). 세계보건기구(WHO) 등의 자료에 의하면 한국은 OECD 국가 중 항생제 사용도가 높으며, 항생제 내성균의 출현율이 높게 나타나고 있다(2).
특히 병원성 미생물의 항생제 내성 문제는 심각하다. 대표적인 병원성 미생물에는 Salmonella, Staphylococcus aureus, Bacillus cereus, Escherichia coli, Listeria monocytogenes 등이 있으며, 대부분 식중독을 일으킨다. 병원성 미생물의 대표적인 슈퍼박테리아에는 메티실린 내성 황색포도상구균(methicillin resistant Staphylococcus aureus, MRSA), 반코마이신 내성 장구균(vancomycin resistant Enterococci, VRE) 등이 있다. 현재 항생제 내성 미생물의 출현에 대한 문제를 해결하기 위해 항생제를 대체할 약물을 개발하거나 항생제 내성균에 대한 항생제 혹은 치료제 개발 등의 연구가 진행되고 있다. 인체에 안전한 약물을 개발하기 위해서 주로 천연물, 단백질 등을 연구하고 있으며, 현재 박테리오파지가 큰 관심을 받고 있다(3).
박테리오파지는 단백질 껍질로 싸여 있는 간단한 구조를 갖고 박테리아를 특이적으로 감염시키는 바이러스의 한 종류로 자연환경 어디에나 존재할 수 있다(4). 또한 박테리아가 존재할 때만 복제되기 때문에 자가 제한이 가능하다(5). 특징으로는 세균의 세포벽을 파괴하고 세포의 내용물이 용해되는 용균작용의 특징을 가지며(6), 두 가지의 생활사인 용원성 생활사(lysogenic cycle)와 용균성 생활사(lytic cycle)를 갖는다. 용원성 생활사는 박테리오파지가 숙주를 감염시킨 후 바로 박테리아를 죽이지 않고 ‘프로파지(prophage)’라는 유전물질을 숙주세포의 DNA에 삽입하여 결합해 공생하며 함께 복제되며, 숙주 환경이 악화되면 숙주 염색체에서 분리되어 용균성 경로로 바뀐다. 반면, 용균성 생활사는 세포분열 과정에서 숙주세포를 죽이며 유전자를 복제하며, 용균성 생활사를 지속적으로 갖는 박테리오파지를 ‘독성 파지’라고 한다(3). 이러한 용균성 생활사를 갖는 박테리오파지는 병원성 미생물에게도 감염시켜 파괴할 수 있기 때문에 현재 다양한 치료연구가 진행되고 있다(7).
이에 본 논문에서는 항생제 사용에 따른 병원성 미생물의 항생제 내성 현황에 대하여 제시하고, 박테리오파지를 이용한 병원성 세균의 억제에 대한 연구 및 응용에 대하여 논하고자 한다.
Ⅱ. 본 론
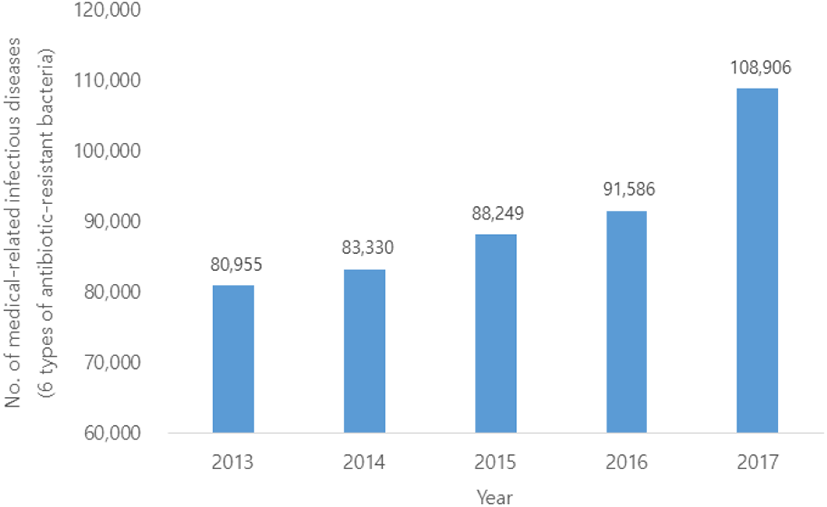
이승재 등(8)은 2013∼2017년의 항생제 내성균 6종(메티실린내성 황색포도상구균(MRSA), 다제내성 녹농균(MRPA), 반코마이신내성 황색포도상구균(VRSA), 반코마이신내성 장구균(VRE), 다제내성 아시네토박터 바우마니균(MRAB), 카바페넴내성 장내세균속균종(CRE)에 대한 질병관리본부의 표본감시체계를 통한 신고 현황 및 특성을 분석하였다. 각각 보고된 총 건수는 453,026건이며, 매년 지속적으로 증가하는 추세를 보이고 있다(Figure 1). 특히, MRSA 신고 건이 가장 많았으며, 매년 평균 47%의 점유율을 차지한다. 대표적인 병원성 미생물에 대한 항생제 내성 현황은 다음과 같다.
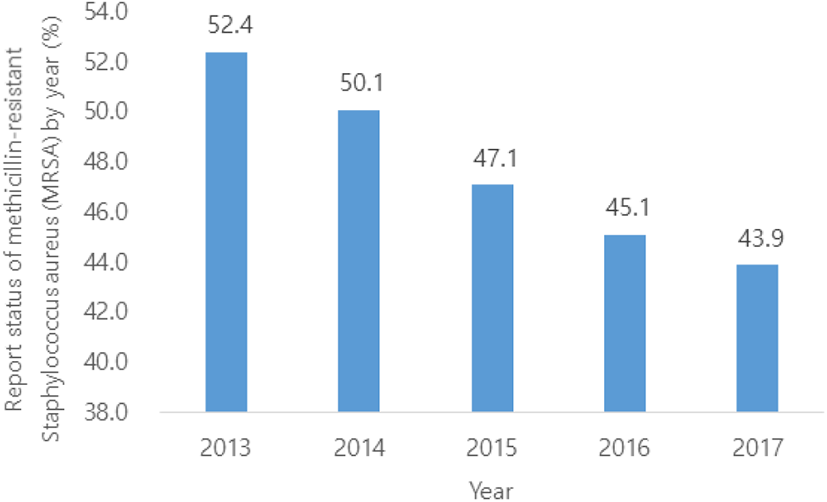
Staphylococcus aureus의 항생제 내성률은 의료관련 감염병 가운데 가장 높은 비율을 차지한다. 각각의 연도별 신고 현황은 메티실린 내성 황색포도상구균(MRSA)의 연도별 신고현황 분석 결과, Figure 2와 같이 2013년부터 2017년까지 52.4%에서 43.9%로 전체 중 차지하는 비율이 점차 감소하는 것으로 나타났다(8). 이는 미국 식품의약국(FDA)에서 항생제의 과한 사용의 문제를 해결하고자 항생제의 사용금지를 권고하며 슈퍼박테리아의 출현을 막고자 하는 노력을 보였으며, 국내에서는 농림축산식품부에서 2011년부터 사료에서의 항생제 사용을 금하는 조치를 취하는 노력을 보였다. 이러한 노력들은 슈퍼박테리아의 출현율을 감소시키는 결과로 나타났다.
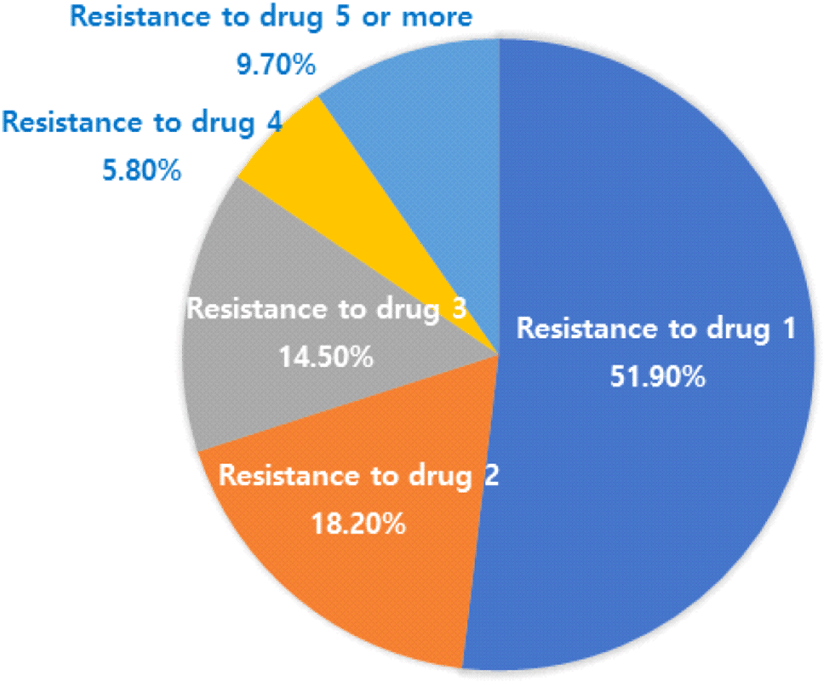
Salmonella를 치료하는 데 사용하는 대표적인 항생제는 nalidixic acid, ampicillin, ticarcillin, chloramphenicol, tetracycline 등이다. 설사 환자에게서 채취한 분변에서 분리된 Salmonella의 91.3%는 한 가지 이상의 항생제 내성이 있었다(Figure 3)(9).
돼지에서 분리한 S. typhimurium 59 균주를 대상으로 진행한 항생제 감수성 시험 결과는 모두 1개 이상의 항생제에 대하여 내성을 가졌으며, streptomycin과 tetracycline에 대해서는 모든 균주에서 내성을 보였고, 이외 59균주에 대하여 chlorampenicol(40.7%), trimethoprim/sulfamethoxazole(35.6%), ampicillin(30.5%), kanamycin(25.4%), gentamycin(11.9%), cephalothin(11.9%), amoxicillin/clavulic acid(10.2%), nalidixic acid(6.8%)에 대해서도 상당한 내성을 나타내었다. 이는 돼지 사료 첨가제와 질병 치료를 위한 항생제 과사용에 기인하는 것으로 추측되었다(10).
B. cereus는 β-lactamase를 생산하는 특징이 있다. β-Lactamase는 베타-락탐 계열 항생제가 갖는 베타-락탐 고리를 끊어 항균효과를 억제하는 효소이며, 베타-락탐 고리는 3개의 탄소와 1개의 질소로 구성된 환형 고리를 가진다(Figure 4). 대표적인 베타-락탐 계열의 항생제로 penicillin이 있다.
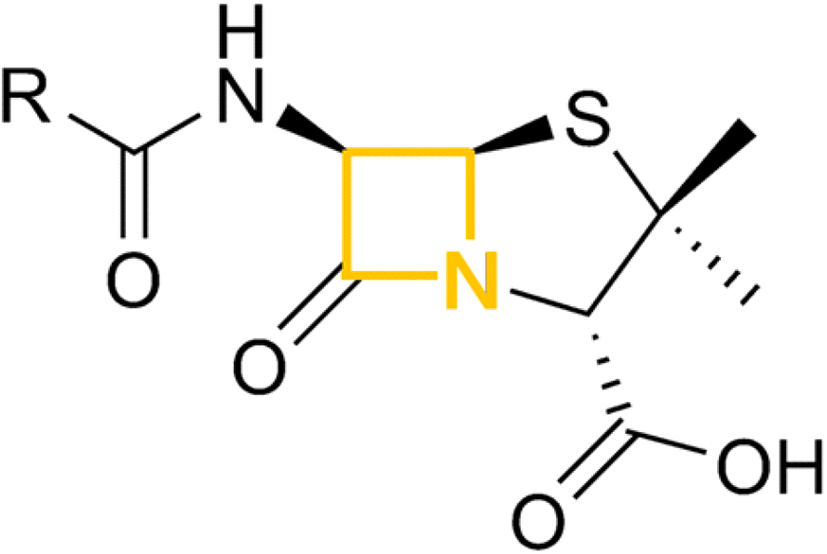
B. cereus가 penicillin과 cephalosporin에 내성이 있었으며(11), Luna(12)의 연구에 의하면 B. cereus는 clindamycin, erythromycin, trimethoprim-sulfamethoxazole에 대한 내성이 있었으며, gatifloxacin, levofloxacin, moxifloxacin, rifampicin, daptomycin, linezolid 항생제에 대해서는 억제되었다.
이영주 등(13)은 항생제 내성을 확인하기 위해 닭의 분변에서 시료를 채집해 대장균을 분리하였고, 이중 항생제의 다중 내성을 갖는 대장균들이 검출되었다. 채희선 등(14)은 소의 배설물과 도체에서 E. coli O157:H7 45 균주를 분리하였으며, sulfisoxazole(24.4%), streptomycin(22.2%), tetracycline (20.0%)에 대하여 내성이 있었고, 8개의 균주가 3개 이상의 항생제에 대하여 내성을 보였다. 또한, 이봉현 등(15)은 소의 젖을 짜는 사육환경의 원유에서 분리한 E. coli O157:H7에 대해 20종류의 항생제에 대하여 내성 여부를 확인한 결과 nalidixic acid와 oxacillin, linezolid 항생제에 내성을 보였다. 한편, 국내 부산지역의 설사 환자 2,125명의 설사로부터 E. coli O157:H10 16종류의 항생제에 대한 내성을 확인한 결과, amikacin, cefotetan, cefepime에 대해서는 내성을 보이지 않았으며, penicillin계의 ampicillin(37.2%), ticarcillin(34.9%)과 cefotaxime(9.3%)에 내성을 보였다(16).
리스테리아증을 치료하기 위해서 ampicillin, penicillin, gentamycin의 항생제를 사용한다. L. monocytogenes는 penicillins, aminoglycosides, tetracycline 등 다양한 항생제에 대한 감수성을 가지고 있다. 국내 식품에서는 상대적으로 연구가 진행되지 않고 있었으며, 이에 정효원 등(17)은 국내 식품에서의 L. monocytogenes에 대한 기초 연구를 제공하였다. 서울지역에서 수거된 식품 1,042건에 대하여 김밥, 생선, 돈육제품, 연어에서 L. monocytogenes 20 균주가 분리되었으며, 각각의 균주에 대하여 항생제 16종에 대한 항생제 감수성 검사를 진행한 결과, cefotetan(55%), cefotaxime(35%), cefepime(30%), tetracycline(15%)에 대해서 내성이 있었다.
Salmonella 균은 세포 내 기생 세균이며, 통성 혐기성 미생물이다(18). 배설물에 오염된 식품에서부터 발생하며, Salmonella의 혈청형에 따라 장티푸스나 위장관 질병을 일으킨다(19).
Huang 등(20)의 연구에 의하면, 2004년과 2005년에 총 232개의 Salmonella 억제 박테리오파지를 육계 생산공정에서 분리하였으며, Salmonella에 대해 가장 보편적으로 나타나는 혈청형 S. enteritidis, S. typhimurium에 감염된 가금류에 박테리오파지를 산성 현탁액으로 투여하여 대조군과 비교하였더니 24시간 내에 S. enteritidis를 ≥4.2l log, S. typhimurium ≥2.19 log 감소시켰다. 또한, 가금류 농장 주변의 하수처리장과 호수에서 분리된 58종류의 Salmonella 억제 박테리오파지인 LPST10, LPST18, LPST2는 효과적으로 S. typhimurium을 억제하였으며, 특히 LPST10은 S. typhimurium과 S. enteritidis를 상대적으로 높은 효율로 억제하였다.
한편, Salmonella에 감염되지 않은 닭에 S. enteritidis 혹은 S. typhimurium을 구강 감염시키고, 7일 후 안락사하여 죽은 닭의 피부에 S. enteritidis 파지 현탁액을 분무하였더니 1분 이내에 감소되었다. 이는 Salmonella에 감염된 육계의 사체에 분무하는 형식으로도 일차적인 균주 감소에 효과를 나타낼 수 있음을 암시한다(21). 즉, 혈청형이 다른 균주에 따라서 각각에 효과적인 파지를 사용할 수 있으며, 또한 분무만으로도 효과가 있어 사용하기 용이함을 알 수 있다.
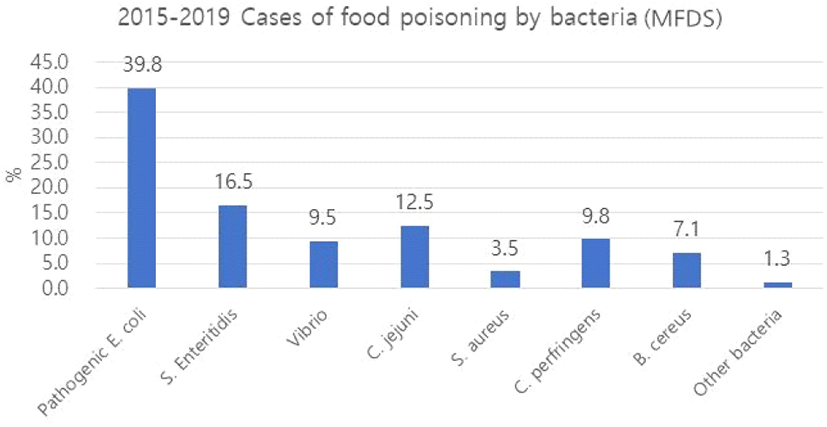
Staphylococcus aureus는 자연계에 넓게 분포하며, 대표적으로 식중독을 일으키는 균으로 증상으로는 복통과 설사 등을 일으키고, 우유, 치즈 등에 오염되면서 감염될 수 있다. 현대 사회에서 식품제조업 발달로 간편하게 먹을 수 있는 즉석조리식품들이 증가됨에 따라 식품, 조리기구, 조리환경 등의 교차오염으로 인한 식중독균 오염의 경우가 자주 발생한다(22). 식품의약품안전처의 우리나라 2015∼2019 식중독 통계자료에 따르면, 여러 식중독균 중 S. aureus 감염 발생 건수가 3.4% 차지했다(Figure 5).
S. aureus 균에 감염된 환자에게서 분리된 박테리오파지 SAP26은 메티실린 내성 S. aureus에 대해 용균작용이 일어났고, 항균제와 함께 사용했을 때 S. aureus를 효과적으로 억제 및 사멸시켰다(23). S. aureus 15981을 넣은 SM Buffer에 박테리오파지 DAR88과 K를 혼합 처리한 경우, 단독으로 처리한 경우보다 효율적으로 성장을 억제했다. 동일한 방법으로 S. aureus H325에 대하여 처리한 경우 성장을 완전히 억제하였고, S. aureus MRSA 252에 대해서도 효과적으로 억제하였다(24). 한편, 박테리오파지는 S. aureus 생물막이 형성된 상처에도 사용되었는데, 토끼의 귀 상처에 S. aureus를 접종 후 S. aureus 특이적 박테리오파지로 매일 치료하여 S. aureus 개체수를 감소시켰다(25). 박테리오파지를 이용한 항생제 내성균 억제와 생물막에 대한 치료 방법은 의료기술의 새로운 접근법이 될 수 있다.
B. cereus는 식중독을 일으키는 균으로 알려져 있으며, 자연에 존재하는 Bacillus는 그람 양성의 간균이고, 통성 혐기성이다(26). Bacillus는 장내에서 Salmonella,Campylobacter와 경쟁하기 때문에 경쟁 미생물의 수를 감소시키며, 알코올에 쉽게 죽지 않아서 알코올을 묻힌 면봉이나 패드에서도 잘 번식한다(27). 다른 Bacillus 종들과 마찬가지로 내생 포자를 생성할 수 있으며, 요리 중 포자형태로 전환되고, 음식물과 같이 흡수되어 장에서 영양세포가 된다. 이러한 B. cereus를 포함한 많은 박테리아는 열이나 살균 처리로 제거가 어려운 생물막을 형성하기 때문에 이를 억제할 수 있는 새로운 방법이 필요하다.
Kim 등(28)의 연구에 의하면, 지렁이가 존재하는 자연계 토양에서 박테리오파지 ФBC01를 발견하였으며, 이는 B. cereus에 특이적으로 감염되었다. 또한 Lee 등(29)이 분리한 박테리오파지 B4는 식중독을 일으키는 B. cereus와 B. subtilis균을 약 20시간 이상 효과적으로 억제하였다. 한편, B. cereus NRRL 569 균주를 억제하는 박테리오파지 CP-51은 DNA 전사 시 B. cereus의 포자 발아 후 시작 단계를 억제한다(30). 이러한 박테리오파지의 세균 억제능은 영양세포에서 작용될 뿐만 아니라, 포자상태에서도 작용될 수 있어 더욱 활용하기 좋을 것으로 판단된다.
E. coli O157은 식용 동물의 대변에서 발견되며, 주로 오염된 물 또는 음식을 먹었을 때 감염이 일어난다. 특히 치명적인 독소를 만들어내는 박테리아이며, 급성 출혈성 설사, 복부 통증을 유발한다(31).
박테리오파지를 이용한 E. coli O157 억제 및 사멸을 일으키는 방법은 여러 가지 실험을 통해 증명되었다. 소 배설물에서 분리된 파지 용액을 양에게 박테리오파지 처리 후 48시간, 72시간이 지남에 따라 양의 맹장과 직장 그리고 분변에서 E. coli O157:H7을 감소시켰으며, 대장균과 박테리오파지 1:1 비율이 가장 효과적임을 확인하였다(32). 한편, E. coli O157:H7 감염에 내성을 갖는 양으로부터 분리된 박테리오파지 CEV1은 혐기 및 호기적으로 성장한 E. coli O157:H7을 감소시켰다. E. coli O157:H7 감염 양에게 박테리오파지 CEV1을 투여하여 48h 경과 후 장 검사 결과, E. coli O157:H7이 2 log 감소되었다(33). 또한 가축공장 폐수를 채취해 분리한 박테리오파지 KFS-EC는 E. coli O157:H7에 농도별(0.01∼100 MOI)로 처리한 결과, 0.01, 0.1 MOI 처리 시 2시간 동안, 그리고 1, 10, 100 MOI처리 시 8시간동안 성장을 억제하였다(34). 이는 박테리오파지의 비율과 시간을 적절히 조절하면 병원성 미생물을 세균을 더욱 효과적으로 억제할 수 있을 것으로 사료된다.
세균성 병원균인 L. monocytogenes는 자연환경의 토양이나 식물에 서식하고, 생체 내에서는 동물세포의 세포질에서 병원체로 존재하며 이들이 서식하는 환경에 따라 대사산물이 극명한 차이를 보인다. 또한 L. monocytogenes는 성장하기 위해 유연한 적응력이 필요하며, 스스로를 보호하기 위해 대사과정에서 독성물질을 만들어낸다(35). L. monocytogenes는 오염된 식품을 섭취함으로써 인체 내로 들어오며, L. monocytogenes는 호냉성 세균으로 냉장상태에서 오랜 기간 보관된 식품에서도 질병을 유발할 수 있다(36).
Lee 등(37)은 L. monocytogenes ATCC 7644, 19114에 대하여 박테리오파지 LMP1, LMP7의 용균작용 효과를 확인하였다. 이때 박테리오파지 LMP1은 L. monocytogenes ATCC 19114를 LMP7보다 효과적으로 억제했고, LMP7은 L. monocytogenes ATCC 7644를 LMP1보다 효과적으로 억제하였다. 두 개의 박테리오파지 LMP1과 LMP7은 서로 다른 균주에 특이적임을 알 수 있었다(37).
이는 같은 종의 미생물에도 각기 다르게 작용되기 때문에 균주에 따라 사용될 수 있는 파지가 다르게 작용됨을 시사하며, 또한 혼합물을 사용한다면 미생물의 스펙트럼을 폭넓게 사용할 수 있을 것이다. 이러한 박테리오파지를 식품 및 의약품 산업에 응용한다면 병원성 미생물의 효율적인 제어가 가능할 것으로 기대된다.
Ⅲ. 결 론
항생제 오·남용에 따른 병원성 미생물의 항생제 내성 문제는 심각하며, 또한 항생제 다제 내성의 슈퍼박테리아는 인간의 생명을 위협하는 무서운 존재가 되었다. 이에 많은 연구자들은 항생제를 대체하기 위한 소재 개발에 힘을 기울이고 있고 다수의 성과도 창출되었다. 그러한 소재 중의 하나가 박테리오파지이며, 이는 숙주 특이적이라는 장점 때문에 최근 들어 각광을 받고 있다. 앞으로 박테리오파지의 안전성, 효과성, 그리고 상업성에 대한 문제가 해결된다면 식품, 화장품, 의약품 시장에서 가장 중요한 소재 중의 하나가 될 것으로 기대된다.