Ⅰ. 서 론
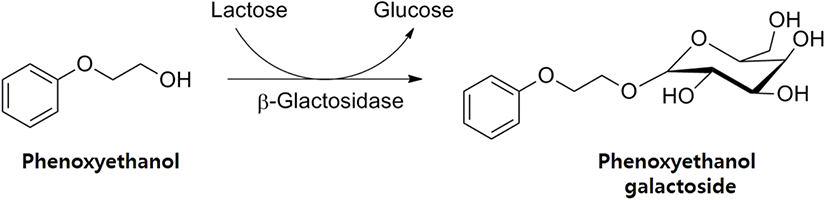
1. Phenoxyethanol(PE, C8H10O2, CAS number 122-99-6)은 화장품에 많이 사용되고 있는 방부제이며, 여러 문헌에서 인체 피부에 문제를 유발한다는 보고가 계속해서 있어 왔다(1, 2). 그동안 본 연구팀에서는 여러 가지 화장품용 방부제의 유사한 피부 트러블에 문제를 해결하기 위하여 방부제 분자에 galactose 한 분자를 결합시키는 transgalactosylation 반응을 이용하여 galactoside 유도체를 합성하고, 이를 방부제의 대체물로 이용하려는 전략을 제시하여 왔다. 이미 본 연구팀의 선행연구에서 화장품용 방부제로 쓰이는 chlorphenesin (CPN)(3, 4), phenoxyethanol(PE)(5, 6), 1,2-hexanediol(HD) (7, 8)의 galactoside 유도체를 대장균 효소(Escherichia coli β- galactosidase, E. coli β-gal)를 이용하여 합성하는 연구를 수행하여왔다. 이러한 galactoside 유도체의 특징은 현저하게 인간 피부 세포에 대한 세포독성이 적다는 것이다(4, 6, 9). 이미 선행연구를 통하여 본 연구에서 합성하려고 하는 phenoxyethanol galactoside(PE-gal)의 합성방법, 정제 및 특성에 대한 연구가 완료된 상태이다(Figure 1)(5, 6). 또한, PE-gal의 인간 피부 세포에 대한 독성연구에서 PE-gal이 PE보다 독성이 적다는 결과도 이미 확인하였다(6). 본 연구에서는 PE-gal을 화장품용 방부제로 실용화하기 위하여 반드시 필요한 경제성 있는 효소 합성공정 확립에 대한 연구를 수행하였다. 이미 CPN- gal 합성의 경우, 연속적인 repeated-batch 방법으로 합성할 수 있다는 것을 선행연구에서 확인하였다(10). 본 연구에서는 같은 전략으로 PE-gal의 합성도 연속적인 repeated-batch 운전 방법으로 가능한지에 대한 연구를 수행하였다. 마찬가지로 E. coli β-gal을 기본적으로 Celite(diatomaceous earth)에 흡착하여 사용하였고, 비교를 위하여 Celite에 흡착된 E. coli β-gal을 동결 건조하여 사용하는 방법에 대하여서도 조사하여 보았다. 본 연구를 통하여 장기간에 걸쳐서 연속적인 PE-gal 합성 가능성이 확인되면, PE-gal의 경제성 있는 생산 방법의 확립으로 저독성의 화장품용 방부제 PE-gal의 실용화에 큰 도움이 될 것으로 기대하고 있다.
II. 재료 및 방법
Phenoxyethanol은 Sigma-Aldrich(St. Louis, MO, USA)에서 구입하여 사용하였고, TLC(thin-layer chromatography) plate는 Macherey–Nagel(Düren, Germany)의 DC-Fertigplatten SIL G-25 UV254를 사용하였다. Celite는 대정화학의 Celite 545를 사용하였으며, 기타 본 연구에 사용한 시약들은 reagent- grade를 사용하였다.
β-Gal을 생산하는 재조합 대장균, 그리고 발현과 관련된 프로모터 시스템과 재조합 대장균을 배양하여 β-gal을 얻는 방법에 대하여서도 선행연구에서 자세히 기술하였다(11).
모든 PE-gal 합성반응에 사용하는 β-gal은 Celite에 흡착시킨 형태나, 아니면 Celite에 흡착 후, 동결건조시킨 형태로 사용되었다. 우선 β-gal을 생산하는 대장균을 Celite에 흡착은 선행연구에서 얻은 방법과 최적 조건을 사용하여 수행하였고(10), 동결건조는 이러한 흡착을 수행한 후, 동결건조기(일신바이오베이스, FD5508)를 이용하여 24시간 동안 건조를 수행하였다.
PE-gal의 합성을 위하여 50 mL conical tube에 50 mM phosphate buffer를 이용하여, 300 g/L lactose, β-gal, 그리고 약 72 mM PE(약 1%)를 넣어 녹였다. 이 때, pH는 8.0으로 조절하였고, 전체 부피를 40 mL 되게 하였다. 그리고 shaking incubator에서 40℃, 100 rpm 조건으로 합성 반응을 수행하였다. 이 때, β-gal을 만드는 E. coli는 Celite에 흡착된 형태나 혹은 Celite에 흡착되어 동결 건조된 형태로 사용되었다. PE-gal 합성에 사용되는 β-gal의 양은 선행연구의 결과를 따라서 정하였고(5, 6), Celite에 β-gal을 만드는 E. coli가 흡착되어 동결 건조된 형태로 사용되는 경우에만 따로 최적의 β- gal 양을 실험을 통하여 정하였다. Repeated-batch 방법으로 합성 반응을 수행할 경우에는 첫 번째 반응이 끝난 후, 50 mL conical tube를 방치하여 반응물의 상등액을 회수하고, 다음 반응에 필요한 PE와 lactose를 다시 넣어 주고, 이어서 두 번째 합성 반응을 수행하였다. 계속해서 합성 반응이 필요한 경우에는 이러한 과정을 계속 반복을 수행하였고, E. coli가 흡착된 Celite나 혹은 E. coli가 흡착된 후 동결 건조된 Celite는 첫 번째 합성 반응에서 한 번만 넣고, 이후로는 넣지 않았다.
20 × 10 cm TLC(thin-layer chromatography) plate에 1.0 μL 시료를 loading하고 acetonitrile : water = 85 : 15(v/v)를 이동상으로 하여 15분 전개하였다. 그리고 staining solution(1.25 g KMnO4, 10 g K2CO3, 1.25 mL 10% NaOH in 200 mL water)를 TLC plate에 뿌린 후, 80℃ oven에서 15분간 말려서 PE와 PE-gal의 spot을 확인하였다. 정량 분석을 위하여 TLC plate를 스캔하여 이미지를 얻은 후, Alphaease FC software(Alpha Innotech, San Leonardo, CA, USA)를 이용하여 PE와 PE-gal 이미지의 면적을 계산하였다.
PE-gal을 정량하기 위하여 선행연구의 방법으로 순수하게 정제하고(6), 농도별로 TLC 분석을 수행한 후, PE-gal 이미지를 분석하였다. 농도별 PE-gal의 이미지 면적과 PE-gal 농도와의 직선관계식을 얻을 수 있고, 이 식을 이용하여 모든 TLC 분석에서 얻은 PE-gal 이미지 면적으로부터 PE-gal의 농도를 정량하였다. PE으로부터 PE-gal로의 전환수율(conversion, %)은 반응 시작할 때, 넣은 PE에서 합성된 PE-gal의 비율에서부터 계산하여 구하였다.
III. 결과 및 고찰
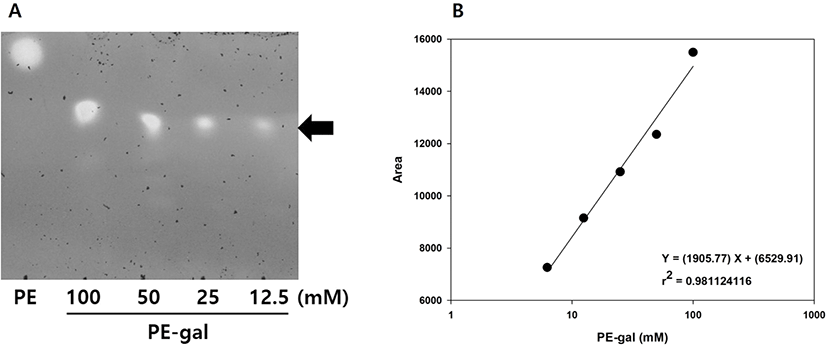
선행연구에서 수행한 PE로부터 PE-gal의 합성 및 정제 방법으로 PE-gal을 순수하게 정제한 후(6), TLC 분석을 이용하여 PE-gal의 농도를 정량하기 위한 standard curve를 만들었다(Figure 2). 12.5에 100 mM의 PE-gal을 TLC로 분석하고(Figure 2A), 그 이미지의 면적을 software를 이용하여 얻은 후, PE-gal 농도와 TLC의 PE-gal 이미지 면적과의 관계를 그래프로 나타내었다(Figure 2B). 두 변수 간의 관계로부터 PE-gal의 농도를 구할 수 있는 직선식을 얻을 수 있었고, 이 직선식을 이용하여 본 연구에서의 모든 PE-gal의 농도를 계산하였다.
Celite와 함께 동결 건조한 E. coli β-gal의 활성 변화를 고려하여, PE로부터 PE-gal 합성에 사용하기 위한 최적의 β- gal 농도를 조사하여 보았다. Figure 3과 같이 0.15에서 0.96 U/mL까지 β-gal 농도를 변화시키면서 6시간 동안 PE-gal 합성을 관찰한 후, 6시간에 합성된 PE-gal 양을 상대적으로 비교하여 보았다(Figure 4). 그 결과, 0.48 U/mL의 β-gal을 가지고 PE로부터 PE-gal을 합성했을 때, 가장 많은 PE-gal이 합성되었다. 이 농도로 Celite와 함께 동결 건조된 β-gal을 사용하여 PE-gal 합성에 계속 사용하였다.
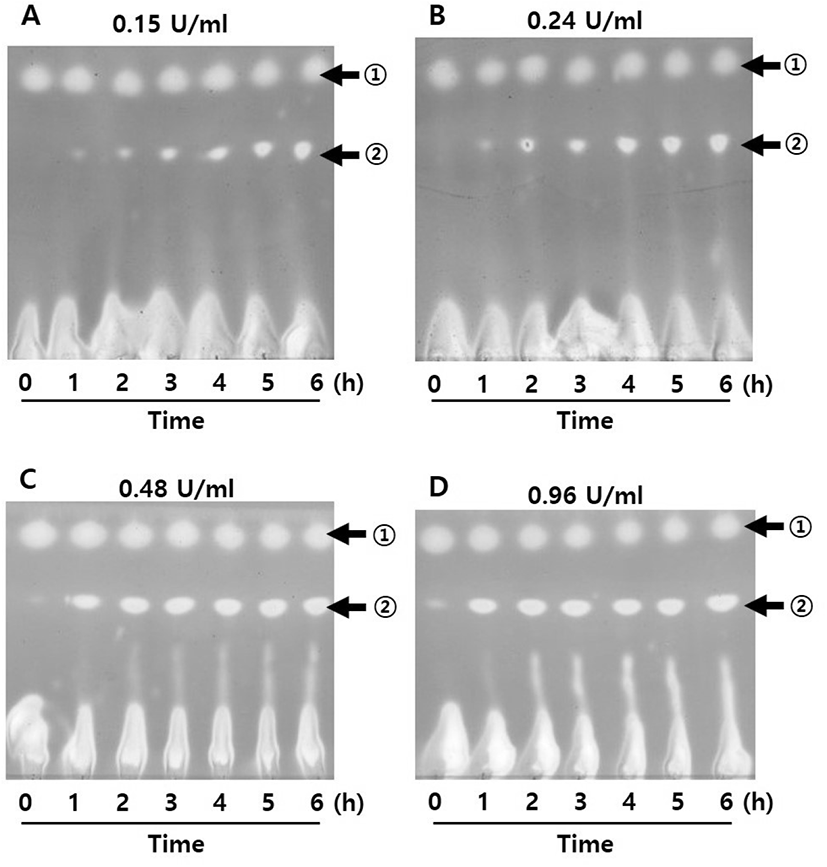
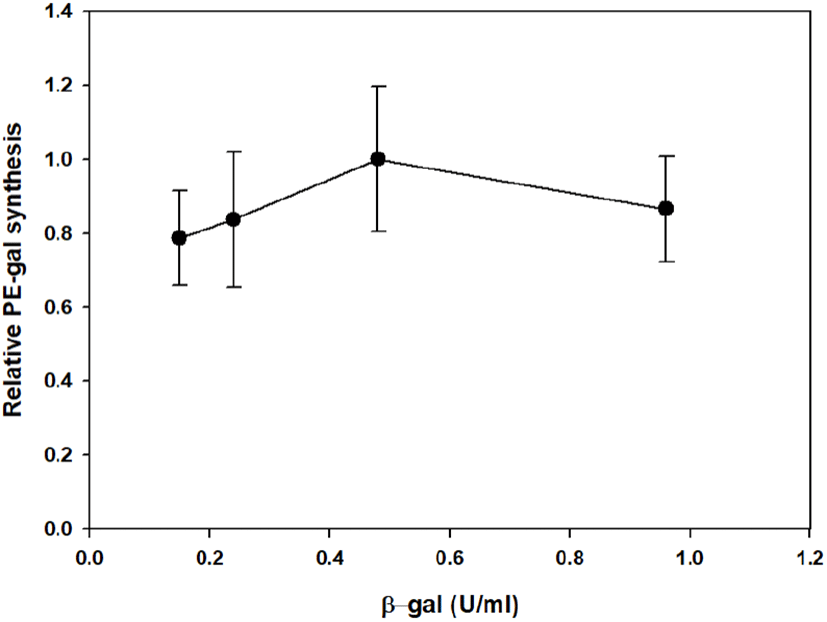
Figure 5는 Celite와 함께 동결 건조된 β-gal을 이용한 연속적인 repeated-batch 방법을 이용한 PE-gal 합성을 조사한 결과이다. 첫 번째 batch에 Celite와 함께 동결 건조된 β-gal를 넣고 그 후로는 넣지 않았다. 그 결과, 세 번째 합성 반응부터 PE-gal의 합성이 급격히 줄어드는 현상을 관찰할 수 있었다. 아마도 동결 건조를 수행하는 동안에 효소의 활성에 영향을 줄 수 있는 물리화학적인 변화가 가해졌을 것으로 추론되어진다. 동결 건조된 β-gal의 경우에 초기에 어느 정도의 효소 활성이 유지되었지만, 반복적인 합성과정에서는 효소의 불안정성 때문에 계속적인 합성을 이어나가지 못한 것으로 보인다. 이러한 변화가 선행연구에서 CPN-gal을 합성할 경우와 같이 오랜 시간 동안 효소의 활성을 유지하면서 효소의 기능을 할 수 있을 것이라는 예상과는 다른 결과를 초래한 것으로 생각된다(10). 그래서 Figure 5와 같이 동결 건조된 β-gal을 사용하여 PE-gal을 합성했을 경우 상대적으로 빨리 효소 활성이 사라지는 결과를 보여준 것으로 생각된다.
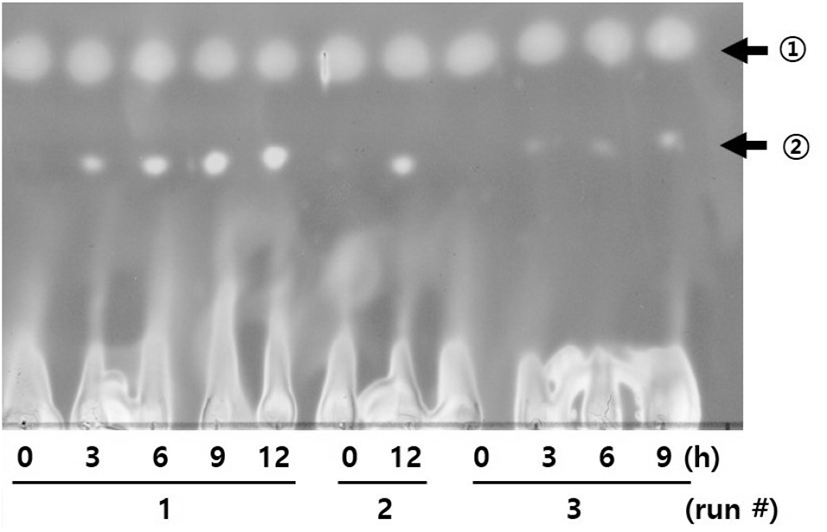
Figure 5에서 같이 Celite에 흡착되어 동결 건조된 β-gal을 이용하여 PE-gal 합성이 세 번째 batch 이후에 진행되지 않는 것을 확인하였다. 그래서 선행연구에서 CPN-gal을 연속적으로 합성할 때(10), 사용했던 방법으로 PE-gal의 합성을 시도해 보기로 하였다. Repeated-batch 방법으로 PE-gal 합성이 가능한지를 확인하기 위하여 Celite에 흡착된 β-gal을 사용하여 연속 4회에 걸쳐서 PE-gal의 합성을 실시하였다. Figure 6과 같이 Celite에 흡착된 β-gal를 사용하여 PE-gal을 합성하였을 경우에는 Celite에 흡착되어 동결 건조된 β-gal을 사용했을 경우에 비하여 문제없이 네 번째 batch까지 PE-gal 합성이 잘 이루어졌다. 다시 말하면, β-gal을 PE-gal 합성에 이용하기 위하여 Celite에 β-gal을 함유한 E. coli를 동결 건조방법보다는 Celit에 흡착하여 이용하는 것이 β-gal의 활성 유지에 더 좋다는 것을 확인할 수 있었다. 이 때, Celite에 흡착된 β-gal은 첫 번째 batch에 한번만 첨가하였고, 사용한 β-gal양 등 합성 조건은 선행연구결과와 같은 조건으로 수행하였다(5, 6).

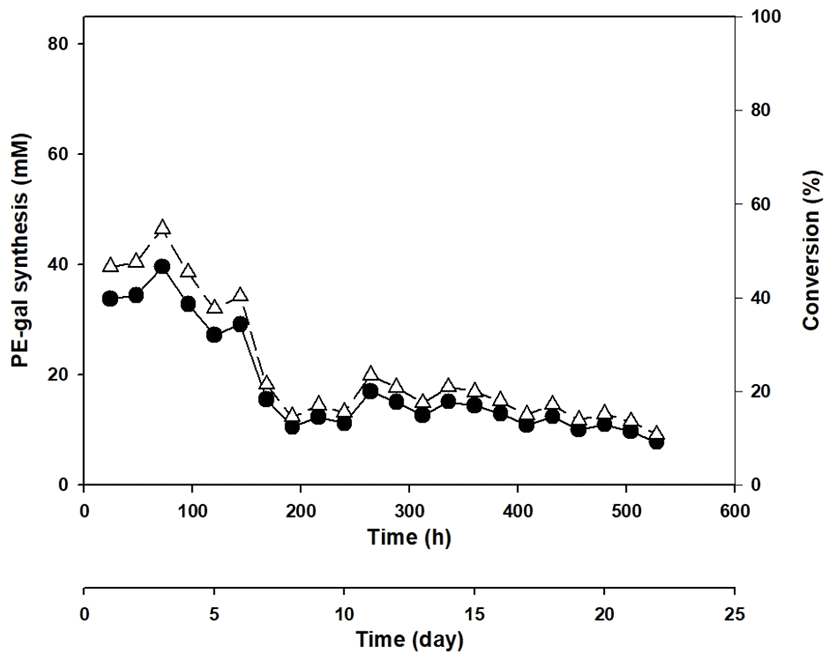
Figure 6의 결과를 근거로 하여 Celite에 β-gal을 함유한 E. coli를 흡착하는 방법으로 long-term repeated batch 방법의 PE-gal 합성을 시도하여 보았다. 이때도 Celite에 흡착된 β-gal은 첫 번째 batch에 한 번만 첨가하였고, 사용한 β-gal 양 등 합성 조건은 선행연구 결과와 같은 조건으로 수행하였다(5, 6). Figure 7과 같이 각 batch를 24시간마다 반복하여, 22일 528시간 동안 22번의 batch 합성을 시도하였고, PE-gal의 합성이 계속해서 중단 없이 일어나는 것을 확인하였다. 이 TLC 결과에서 PE-gal를 정량하여 그래프로 분석한 결과가 Figure 8인데, PE-gal 합성이 세 번째 batch까지는 큰 문제없이 일어났으나, 그 이후부터는 급격히 감소되는 것을 확인할 수 있었다. 이때까지 약 72 mM PE로부터 평균 약 50% 수율로 약 36 mM PE-gal이 합성되었으나, 그 후로 급격히 PE-gal 합성이 감소해서 192시간 8일이 지난 후에는 수율이 약 14.5%로 약 10.5 mM의 PE-gal만이 합성되었다. 이어서 192시간 8일부터 528시간 22일까지는 PE-gal 합성이 완만히 감소되는 추세를 보였으며, 최종 합성이 종료되는 시점에서는 약 10.7%의 합성 수율로 약 7.7 mM의 PE-gal이 합성되었다.

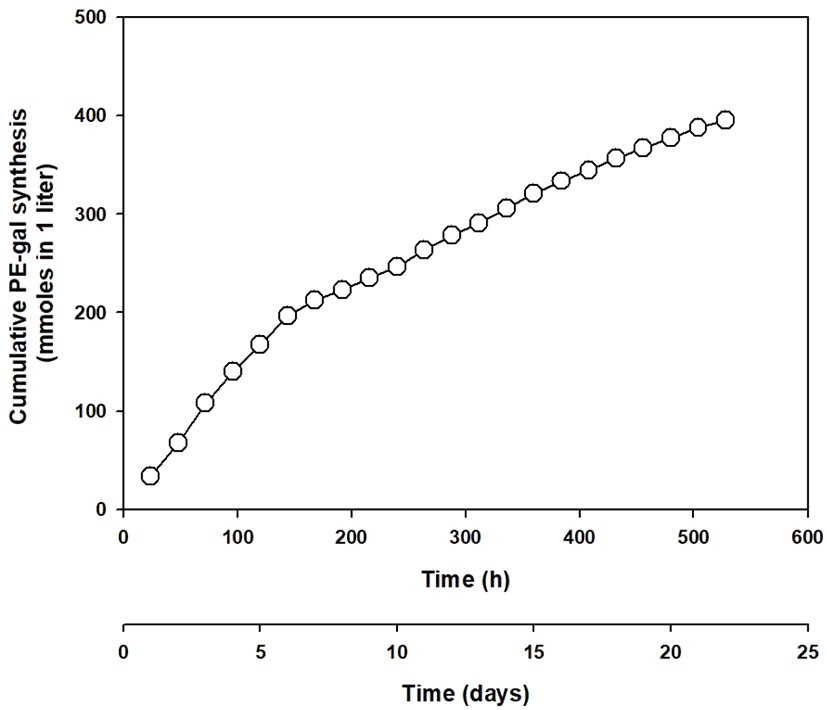
연속적인 repeated-batch 운전을 통한 PE로부터 PE-gal의 합성에 대한 분석을 위하여, Figure 9와 같이 cumulative PE- gal 합성량을 조사하여 보았다. Figure 9에서와 같이 cumulative PE-gal 합성량은 192시간 8일 전후로 PE-gal 합성량의 증가 양상에 확연한 차이를 보였다. 192시간 8일 전보다 그 후부터 합성량 증가가 완만하게 관찰되었다. 이것은 Figure 8에서 언급한 192시간 8일에서의 PE-gal 합성 양상의 변화와도 같은 결과이다. 아마도 이 시간 정도에서 β-gal을 흡착하고 있는 Celite에 변화가 있었을 것으로 생각되어진다. 추측하건데 192시간 8일 이전에는 Celite 표면과 안쪽에 흡착된 모든 E. coli 세포의 β-gal이 합성에 관여하였으나, 시간이 지나면서 192시간 8일 이후부터는 Celite 표면 등 E. coli 세포의 β-gal이 Celite에서 떨어져 나갔을 것으로 생각되어진다. 그래서 192시간 8일 이후부터는 어느 정도 일정한 양의 PE- gal이 비록 감소 추세를 보였지만 계속적으로 합성되어진 것으로 생각된다. Figure 9의 그래프의 제일 마지막 시간의 data는 연속적인 repeated-batch 운전을 통한 PE-gal 합성의 cumulative 합성량을 표시하고 있다. 그 결과를 종합해 보면, 본 합성반응을 통하여 총 528시간 22일 동안 합성된 PE-gal의 모든 양은 1.0 liter 기준으로 약 395.3 mmole의 PE-gal라는 것을 알 수 있다.
IV. 결 론
본 연구에서는 PE로부터 PE-gal의 연속적인 repeated- batch 합성 방법에 대하여 연구를 수행하였다. Celite에 흡착된 β-gal를 사용하여 PE-gal을 합성할 경우 Celite에 흡착되어 동결 건조된 β-gal을 사용하는 방법보다 β-gal의 효소 합성 능력에 어떠한 변화도 없이 PE-gal 합성이 잘 이루어졌다. 이러한 결과를 근거로 하여 long-term repeated batch 방법으로 PE-gal 합성을 시도하여, 22일 528시간 동안 22번의 batch 합성을 수행할 수 있었다. 이 때, 세 번째 batch까지는 약 72 mM PE로부터 평균 약 50% 수율로 약 36 mM PE-gal이 합성되었으나, 그 후로 PE-gal 합성이 감소해서 192시간 8일이 지난 후에는 수율이 약 14.5%로 약 10.5 mM의 PE-gal만이 합성되었다. 192시간 8일부터 528시간 22일까지는 PE-gal 합성이 완만히 감소되는 추세를 보였으며, 최종 합성이 종료되는 시점에서는 약 10.7%의 합성 수율로 약 7.7 mM의 PE-gal이 합성되었다. 본 합성반응을 통하여 총 528 시간 22일 동안 합성된 PE-gal의 모든 양은 1.0 liter 기준으로 약 395.3 mmole의 PE-gal이었다. 본 연구를 통하여 장기간에 걸쳐서 연속적인 PE–gal 합성 가능성이 확인되었으며, PE-gal의 화장품용 방부제 실용화에 도움이 될 것으로 기대하고 있다.