Ⅰ. 서 론
아티초크(Cynara scolymus L.)의 원산지는 지중해 연안이다. 국화과에 속하는 다년생식물이며, 주로 프랑스, 이태리, 스페인 등 유럽지역에서 많이 소비되는 채소이다. 아티초크는 단백질, 탄수화물 및 섬유질과 같은 필수 영양 성분의 좋은 공급원이 될 수 있고, 대사 과정의 핵심 역할을 한다(1). 따뜻한 지역에서 자라는 아티초크는 국내의 경우 제주지역에서 수확할 수 있다. 10월 정도에 정식할 경우, 이듬해 4월 하순부터 6월까지 수확이 가능하다(2). 아티초크는 최근 새롭게 국내에 도입되는 작물로 Kim 등의 연구에 따르면 국내 재배현황은 5가구, 1 ha 미만으로 극히 적은 면적에서 재배되고 있는 상황이다(3).
아티초크는 박테리아, 효모 및 곰팡이에 대해 항균 활성을 나타내며, 잎 부분에는 항산화 활성을 조절하는 플라보노이드와 페놀 화합물을 함유하고 있다(4, 5). 아티초크에 함유된 페놀 화합물로서 시나린(cynarin)은 콜레스테롤, 트리글리세리드 저하 효과가 있는 것으로 확인되었으며, 고혈당 또는 고지혈증 환자에게 잠재적으로 유익할 수 있다(6).
항산화 작용에 주요 요소인 활성산소종(reactive oxygen species, ROS)은 생체 내에서 생리활성 과정 중에 생성되기도 하고, 오염물질이나 바이러스 등에 노출되거나 약물, 스트레스 등의 요인에 의하여 생성되기도 하는데, 화학적인 활성이 매우 높아서 주위에 있는 생체분자인 세포막을 이루는 지질이나 단백질 등에 반응함으로써 이들 생체분자를 공격하여 정상적인 기능을 차단하게 된다(7). ROS는 호기성 대사의 결과로서 정상적인 상태에서 항상 생성되며, ROS에는 super oxide anion(O2), hydroxyl radical(—OH), hydrogen peroxide radical(—OOH) 등이 있는데, 이들은 높은 화학적 반응성 때문에 일시적으로만 존재하며, 유해한 방식으로 DNA, 단백질, 탄수화물, 지질 등과 반응할 수 있고, 세포는 ROS에 대항하기 위한 다양한 항산화 체계를 갖고 있으나, ROS가 세포의 보호체계를 압도하여 산화 환원 항상성을 변화시키게 될 때 결과적으로 oxidative stress를 입게 된다(8). 이를 해결하기 위해 많은 항산화제 개발이 이루어지고 있는데, 현재 개발되어 사용되고 있는 합성 항산화제는 발암성 관련 보고가 있어, 보다 안전하고 강력한 천연 항산화제의 개발이 요구되고 있다(9).
용매의 경우 메탄올, 물, 아세톤 및 석유 에테르와 같은 극성이 다른 용매를 사용하여 다양한 매트릭스에서 페놀 화합물을 추출하는 여러 추출 기술이 보고되고 있다(10). 에탄올과 물은 이러한 유기용매에 비해 취급이 안전하여 추출 용매로 주로 사용되었으며, “like dissolve like” 원리에 따르면 용매와 화합물의 극성이 유사할수록 추출에 용이한 것으로 알려져 있다(11).
따라서 본 연구는 아티초크를 농도별로 추출하고, 항산화 활성을 비교하여 천연 항산화제로써의 아티초크 최적 추출 조건을 구명하고자 한다.
Ⅱ. 재료 및 방법
본 연구에서 사용한 아티초크는 시중에서 아트초크 원물분쇄 분말(JOSE MARIA BOU S.L., Spain)을 구입하여 —20℃에서 보관하며 사용하였다.
아티초크 추출물 제조는 분말시료 20 g에 에탄올 500 mL를 비율별(0, 10, 30, 50, 80%)로 가하고, 항온수조(BS-31, Jeio Tech, Korea)를 이용하여 50℃에서 2시간 동안 추출하였다. 추출물은 200 mesh로 여과한 후 여과지(advantec No.2, Toyo Roshi Kaisha, LTD., Japan)로 감압여과하고 회전 감압 농축기(N-1000, Eyela, Japan)를 사용하여 농축하고 —80℃에서 냉각 후 동결건조기(FD8508, Ilshinbiobase Co., Korea)를 이용하여 동결건조하여 분말 상태로 —80℃에서 보관하면서 시료로 사용하였다.
추출물의 수율은 동결건조하여 얻은 각각의 건물 중량을 구하고, 추출물 제조에 사용된 원료의 건물량에 대한 백분율로 나타내었다. 색도는 추출분말 시료를 Y=91.8, x=0.3136, y=0.3196(L=96.73, a=0.08, b=1.91) 값의 표준백색판으로 보정된 색도계(MINOLTA, CR-300, Japan)를 사용하여 측정하였다. Hunter scale에 의한 L(lightness), a(redness — greenness), b(yellowness — blueness) 값을 측정하였고, Chroma value는 아래의 계산식에 의해 산출하였다.
총 폴리페놀 함량은 Kim 등의 방법(12)을 일부 변형하여 측정하였다. 시료 2 mL에 증류수 8 mL를 가하고 2 N Folin-Ciocalteu’s phenol reagent 시약(Sigma-Aldrich, USA)을 1 mL 가하고 5분간 반응시킨 후, 7 % Na2CO3 용액 10 mL를 가하고 실온 암소에서 2시간 반응시켰다. 반응 후 spectrophotometer (Optizen POP, Mecasys Co., Korea)를 이용하여 750 nm 파장에서 흡광도를 측정하였다. 대조구는 Gallic acid(Sigma-aldrich, USA)를 농도별로 희석하고, 표준곡선을 작성하여 시료 중의 총 폴리페놀 함량을 정량하여 gallic acid equivalents (mg GAE/g)로 환산하여 나타냈다.
총 플라보노이드 함량은 Lee 등의 방법(13)을 이용하여 측정하였다. 시료 5 mL에 5% sodium nitrite 0.75 mL를 혼합하여 실온에서 6분간 반응시킨 후 10% aluminium chloride 1.5 mL를 첨가하고, 실온에서 5분간 반응시킨 다음 1 N NaOH 5 mL와 혼합한 후 spectrophotometer를 이용하여 510 nm에서 흡광도를 측정하였다. 총 플라보노이드 함량은 (+)- Catechin hydrate(Sigma-aldrich, USA)를 농도별로 희석하고, 표준곡선을 작성하여 catechin equivalents(mg CE/g)로 환산하여 나타냈다.
DPPH(2,2-diphenyl-1-picrylhydrazyl)에 대한 radical 소거능은 DPPH의 환원력을 이용하여 측정하였다(14). 즉, 시료 1 mL에 0.2 mM DPPH용액(99.9 % ethyl alcohol에 용해) 9 mL를 가하고 10초간 혼합한 후 실온 암소에서 10분간 반응시키고, spectrophotometer를 이용하여 517 nm 파장에서 흡광도를 측정하였다. DPPH radical 소거능은 ascorbic acid를 농도별로 희석하고 표준곡선을 작성하여 Ascorbic acid Equivalent Antioxidant Capacity(mg AEAC/g)로 환산하여 나타냈다.
ABTS[2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)]에 대한 radical 소거능은 Ku 등의 방법(15)을 일부 변형하여 측정하였다. 7 mM ABTS와 2.45 mM potassium persulfate를 1:1 비율로 혼합하여 실온인 암소에서 12∼16시간 동안 방치하여 ABTS+를 형성시킨 후 734 nm에서 흡광도 값이 0.850±0.20이 되게 증류수를 사용하여 희석하였다. 시료 0.1 mL에 ABTS reaction 혼합물 2.9 mL를 첨가하여 혼합 후 실온 암소에서 10분간 반응시킨 다음 spectrophotometer를 이용하여 734 nm에서 흡광도를 측정하였다. ABTS radical 소거능은 ascorbic acid를 농도별로 희석하고, 표준곡선을 작성하여 Ascorbic acid Equivalent Antioxidant Capacity(mg AEAC/g)로 환산하여 나타냈다.
Ⅲ. 결과 및 고찰
에탄올 농도별 아티초크 추출물의 수율과 색도는 Table 1과 같다. 0% 에탄올 추출물의 수율은 25.38%로 가장 높게 측정되었고, 10% 에탄올 추출물은 24.42%, 30% 에탄올 추출물은 24.38%, 50% 에탄올 추출물은 24.1%, 80% 에탄올 추출물은 13.29%로 에탄올 농도가 증가할수록 수율이 낮게 측정되었다. 이러한 결과는 Kim 등의 연구(16)에서 에탄올 농도별 건조 톳의 추출 수율이 70% 이상에서는 에탄올 농도가 증가할수록 추출 수율이 급격히 감소하는 경향을 보인다고 보고한 것과 유사한 경향을 나타내었다.
색도 측정 결과, 명도를 나타내는 L값의 경우 10% 에탄올 추출물에서 45.93±2.30으로 가장 높게 측정되었고, 80% 에탄올 추출물에서 25.49±1.79로 가장 낮게 나타났다. 적색도를 의미하는 a값, 황색도를 의미하는 b값, 채도를 의미하는 Chroma value는 0%에서 50%까지 에탄올 농도가 증가할수록 값이 증가하다가 80% 에탄올 추출물에서 큰 폭으로 감소하여 가장 낮은 경향을 나타내었다.
식물유래 항산화제인 폴리페놀은 한 개 이상의 수산기를 가지고 있는 물질로 단백질과 효소, DNA 및 세포막 등의 활성산소에 의한 손상을 예방하는 중요한 항산화 물질이다(17). 에탄올 농도별 아티초크 추출물의 총 폴리페놀 및 플라보노이드 함량은 Table 2와 같다. 0% 에탄올 추출물 67.42±0.64, 10% 에탄올 추출물 71.53±0.46, 30% 에탄올 추출물 76.71±0.15, 50% 에탄올 추출물 82.57±0.52 mg GAE/g으로 총 폴리페놀 함량은 0%에서 50%까지 에탄올 농도가 증가할수록 증가하다가 80% 에탄올 추출물은 78.60±1.32 mg GAE/g으로 감소하였다. 이는 백장미 꽃잎을 대상으로 항산화 활성을 연구한 Choi 등의 연구(18)와 비슷한 경향을 나타내었다.
| Sample | TPC (mg GAE/g) | TFC (mg CE/g) |
|---|---|---|
| 0% EtOH | 67.42±0.64a | 45.48±0.33a |
| 10% EtOH | 71.53±0.46b | 48.03±0.31b |
| 30% EtOH | 76.71±0.15c | 52.12±0.07c |
| 50% EtOH | 82.57±0.52e | 56.38±0.26d |
| 80% EtOH | 78.6±1.32d | 58.84±0.47e |
플라보노이드는 독성은 거의 나타나지 않고 생체 내 산화작용을 억제하는 항산화 작용이 강하다는 사실이 알려지면서 플라보노이드계 물질들의 개발과 활용이 기대되어지고 있다(19). 총 플라보노이드는 0% 에탄올 추출물 45.48±0.33, 10% 에탄올 추출물 48.03±0.31, 30% 에탄올 추출물 52.12± 0.07, 50% 에탄올 추출물 56.38±0.26, 80% 에탄올 추출물 58.84±047 mg CE/g으로 측정되었다. 에탄올 농도가 증가할수록 총 플라보노이드 함량이 증가하였는데, Park 등의 연구(20)에서 플라보노이드류는 polyphenolic substance로서 화학구조에 따라 물과 에탄올에 대한 용해도에 차이가 있다고 보고되었으며, 에탄올 농도가 증가할수록 비타민나무 잎 추출물의 총 플라보노이드 함량이 증가하는 경향을 보고한 것과 유사하다.
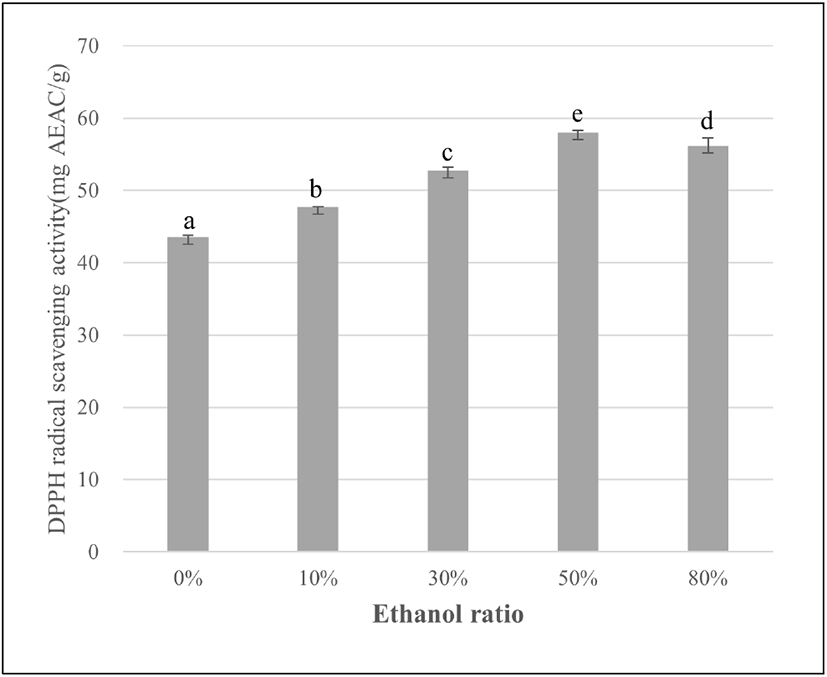
DPPH는 산화된 형태에서 free radical이 cysteine, glutathion, aromatic amine, BHA(butylated hydroxyl anisole) 등에 의해 전자를 얻고 환원되어 짙은 자색의 DPPH가 diphenylpicryl hydrazine으로 탈색되는 것을 이용하여 다양한 천연소재로부터 항산화 물질을 검색하는데 널리 이용되고 있다(21). 에탄올 농도별 아티초크 추출물의 DPPH radical 소거능(mg AEAC/g)은 Figure 1과 같다. DPPH radical 소거능은 0% 에탄올 추출물 43.50±0.27, 10% 에탄올 추출물 47.68±0.07, 30% 에탄올 추출물 52.76±0.47, 50% 에탄올 추출물 58.01±0.23, 80% 에탄올 추출물 56.19±1.02 mg AEAC/g으로 0%에서 50%까지 에탄올 농도가 증가할수록 DPPH 라디칼 소거능이 증가하였고, 80%에서 감소하였다. 이는 총 폴리페놀 함량과 비슷한 경향을 나타내었으며, Lee 등의 연구(22)에서 DPPH radical 소거능은 총 폴리페놀의 함량과 관련이 높다고 보고한 것과 일치하는 결과를 나타내었다.
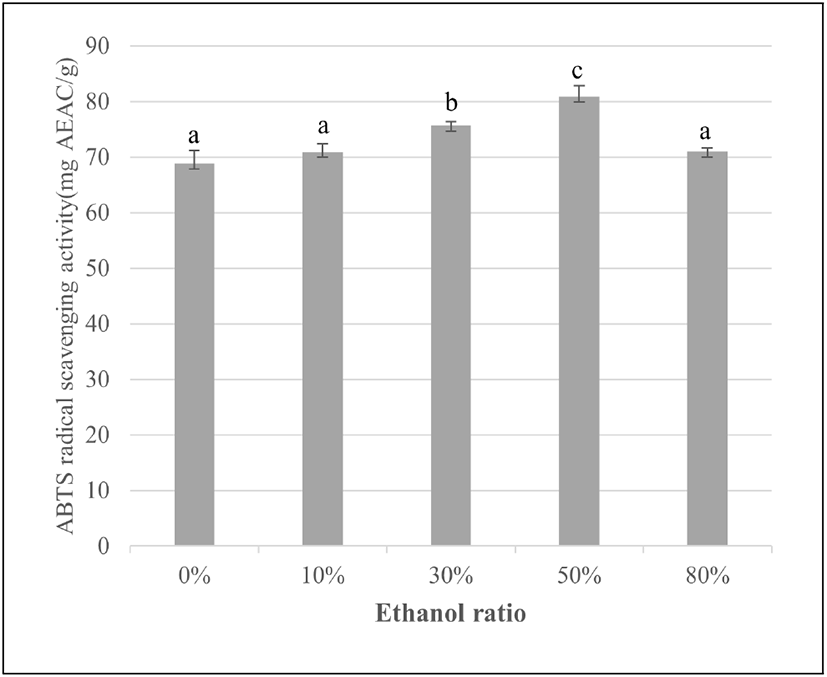
ABTS와 potassium persulfate와의 반응에 의해 생성된 ABTS radical은 시료에 함유된 항산화성 물질의 항산화력에 의해 전자를 받아 무색의 물질로 환원시키며, 소수성과 친수성 시료 모두에 적용 가능하다(23). 에탄올 농도별 아티초크 추출물의 ABTS radical 소거능(mg AEAC/g)은 Figure 2와 같다. ABTS 라디칼 소거능은 0% 에탄올 추출물 68.83±2.28, 10% 에탄올 추출물 47.68±1.47, 30% 에탄올 추출물 75.70±0.66, 50% 에탄올 추출물 80.87±1.93, 80% 에탄올 추출물 71.00±0.62 mg AEAC/g으로 0%에서 50%까지 에탄올 농도가 증가할수록 ABTS radical 소거능이 증가하였으나, 0%와 10% 간에는 유의한 차이가 나지 않았다. 또한, 80% 에탄올 추출물의 ABTS radical 소거능이 0%와 10% 에탄올 추출물과 유의한 차이가 나지 않을 정도로 큰 폭으로 감소하여 DPPH radical 소거능 결과와 차이를 나타내었다. ABTS radical 소거능은 DPPH radical 소거능과 원리는 동일하지만, ABTS는 양이온 라디칼을, DPPH는 음이온 라디칼의 소거능을 측정하는 방법으로 두 방법에 대한 기질과 반응물질과의 결합정도가 달라 추출물을 이용한 라디칼 소거능 측정값에서 차이가 나타난다는 보고(24)가 있어 이러한 결과 차이를 만든 것으로 판단된다.
Ⅳ. 결 론
본 연구에서는 에탄올 농도를 달리한 아티초크 추출물의 항산화 활성 및 수율, 색도를 측정하였다. 에탄올 농도별 아티초크의 수율의 경우 0% 에탄올 추출물의 수율이 25.38%로 가장 높게 나타났다. 색도의 측정값은 L값의 경우 10% 에탄올 추출물에서 가장 높게 측정되었고, a값, b값, Chroma value는 0%에서 50%까지 에탄올 농도가 증가할수록 값이 증가하다가 80%에서 감소하는 경향을 보였다. 총 폴리페놀 함량의 경우도 0%에서 50%까지 에탄올 농도가 증가할수록, 67.42±0.64, 71.53±0.46, 76.71±0.15, 82.57±0.52로 함량이 증가하다가 80%에서 78.60±1.32로 감소하였다. 총 플라보노이드 함량은 폴리페놀과 다르게 0%에서 80%까지 45.48±0.33, 48.03±0.31, 52.12±0.07, 56.38±0.26, 58.84±047로 꾸준한 증가추세를 보였다. DPPH radical 소거능과 ABTS radical 소거능의 경우도 총 폴리페놀 함량과 같이 0%에서 50%까지 각각 43.50±0.27, 47.68±0.07, 52.76±0.47, 58.01±0.23와 68.83±2.28, 47.68±1.47, 75.70±0.66, 80.87±1.93으로 에탄올 농도가 높아질수록 값이 증가하였고, 80% 에탄올에서 DPPH radical 소거능과 ABTS radical 소거능이 각각 56.19±1.02와 71.00±0.62로 감소하였다.
따라서 아티초크 추출 시 50% 에탄올을 이용할 경우 가장 높은 항산화 활성을 나타내는 것을 보아 50% 에탄올을 이용한 추출이 최적의 추출 조건으로 적합할 것으로 판단된다.
