Ⅰ. 서 론
김치는 우리나라의 전통 발효 식품으로 무, 배추, 오이 등의 여러 채소를 소금에 절이고 양념을 버무려 발효시킨 식품이며(1), 쌀이 주식인 우리의 식생활에서 식이섬유소, 비타민, 무기질 등을 공급해 주는 중요한 반찬이다. 또한, 김치는 담그는 과정에서 사용된 원료에 존재하는 다양한 미생물을 통해 발효가 이루어진다(2). 하지만 김치의 저장 동안 부패효모의 일종인 백색집락 형성 효모(white colony-forming yeasts, WCFY)의 생육으로 김치 표면에 흰색 산막이 발생하게 된다(3). 김치 표면에 생성되는 흰색 산막을 골마지라 하며, 수분이 많은 발효식품의 겉표면에 발생하는 곰팡이와 같은 흰색 막을 일컫는다. 따라서 이러한 골마지를 형성하는 효모를 골마지 효모라 부르기도 한다. 김치 표면에 생성된 골마지는 장기 저장 시 공기 중에 노출된 김치에서 발생하며 특히 발효 후기에 유산균이 줄어들면서 산막 효모에 의해 나타나는 것으로 알려져 있다(4). 백색집락 형성 효모는 김치의 외관적인 문제와 함께 휘발성 물질에 의한 향미, 조직감 등 관능적인 문제를 통해 김치의 품질을 저하시킨다(5). 골마지 자체는 독성이 없기 때문에 가정에서는 세척 후 섭취하였으나, 수출용 김치의 경우, 장시간의 운반과 보관 과정 중에 골마지가 생성되어 상품의 가치를 저하시키고, 심지어 회수의 대상이 되기 때문에 골마지가 발생하지 않도록 산막 효모를 제어할 수 있는 기술에 대한 연구가 필요한 실정이다(6).
식품의 저장기간 동안 미생물학적 품질을 향상시키기 위해서는 부패 미생물을 제어할 필요가 있으며, 이전부터 절임류 채소에 존재하는 미생물을 제어하기 위해 안식향산나트륨, 소르빈산칼륨 등 화학적 보존제가 사용되어 왔다(7). 그러나 김치의 경우, 이러한 화학적 보존제의 사용을 엄격하게 금지하고 있으며(8), 소비자들 또한 김치에 화학적 보존제 첨가에 대한 강한 거부감을 가지고 있기 때문에, 자연에서 얻어지는 천연항균물질을 사용하여 김치의 표면에 생성되는 골마지 생성 효모를 제어할 수 있는 방법을 연구할 필요가 있다. 이전 연구에서는 식품의 부패를 방지하기 위해 천연항균제로 자몽(9), 녹차(10), 강황(11) 추출물 등을 이용해 왔으나, 추출물 특유의 색깔과 향 때문에 식품에 적용하는데 한계가 있다. 이에 반해 천연항균물질인 키토산(chitosan)은 무색·무취하기 때문에 식품의 관능적인 특성에는 전혀 영향을 미치지 않아 그 적용 가능성이 상대적으로 높은 편이다.
키토산은 게, 새우 등 갑각류의 껍질이나 곤충의 피부, 버섯 등의 세포벽에 널리 분포되어 있는 천연 고분자 다당류인 키틴(chitin)을 탈아세틸화 과정을 통해 얻을 수 있다(12). 키토산은 이전 연구에서 다양한 미생물의 생육억제 및 살균력이 과학적으로 입증되어 왔다. 예를 들면, Oh 등(14)은 인체에 유해한 미생물인 Escherichia coli O157:H7, Staphylococcus aureus 및 Candida albicans에 대한 키토산의 긍정적 효과를 나타냄을 확인하였다. 또한, 키토산을 첨가한 식빵(15)과 메밀묵(16) 등에서 세균의 증식을 억제하여 저장성을 향상시키는 것으로 알려져 있다. 이렇듯, 키토산은 다양한 식품의 저장성 향상 연구에 많이 이용되어 왔지만, 김치에 골마지를 생성하는 백색집락 형성 효모의 생육 억제 효과에 대한 연구는 아직 발표된 적이 없었다. 따라서 본 연구에서는 김치의 저장성 향상을 위해 수용성 키토산의 골마지 생성 효모 생육 억제 효과를 평가하였다.
Ⅱ. 재료 및 방법
본 연구에서 사용된 효모는 3종으로 김치의 표면에 생긴 흰색 골마지에서 직접 분리된 Kazachstania servazzii MGB0660과 고춧가루에서 분리된 Pichia kudriavzevii MGB1001, Hanseniaspora uvarum MGB1002를 사용하였으며, 세 균주 모두 세계김치연구소로부터 분양받았다. 각 효모는 9 mL Yeast Extract Peptone Dextrose broth(YPD broth; BD, Sparks, NV, USA)에 접종하여 25℃에서 48시간 배양하여 약 107∼108 CFU/mL로 생육시킨 뒤 약 105 CFU/mL까지 희석한 후 본 연구에 사용하였다.
김치는 서부농산 영농조합법인(Goesan-gun, Korea)에서 당일 만들어진 제품을 공급받아 사용하였다. 수용성 키토산(MW: 10,000∼100,000)은 ㈜바이오 폴리텍(Cheongju, Korea)의 제품을 증류수 또는 배지에 1.0%(w/v) 농도로 녹여 멸균 후 사용하였으며, 키토산의 pKa값(pKa 6.2)과 숙성이 알맞게 끝난 김치의 pH(약 pH 4.6)를 고려하여 젖산(Samchun, Pyeongtaek, Korea)을 약 0.1% 첨가하여 pH 4.5∼5.0으로 맞추어 실험에 사용하였다.
각 효모에 대한 1.0% 키토산의 항균력 평가는 우선 배지 상에서 진행되었다. YPD broth에 키토산과 젖산을 각각 혹은 병용해서 첨가한 YPD broth 9 mL에 48시간 배양시킨 백색집락 형성 효모를 희석한 후 약 5 log(CFU/mL)로 접종하여 25℃에서 48시간 각 효모의 생육을 관찰하였으며, 키토산과 젖산 모두 첨가하지 않은 YPD broth에서 각 효모의 생육을 관찰한 것을 대조군으로 하였다. 효모의 생육 관찰을 위해 0, 4, 8, 24, 48시간마다 시료를 채취하였다. 채취한 시료는 10배 희석법에 따라 phosphate buffered saline solution (PBS; Biosesang, Seongnam-si, Korea)으로 적절히 희석한 후 Yeast Extract Peptone Dextrose agar(YPD agar; BD)에 도말하였다. 도말된 배지는 25℃에서 약 48시간 배양 후 배지에 생성된 효모의 집락수를 계수하여 효모 균수를 측정하였다.
김치는 배추의 잎 부분과 줄기 부분으로 나누고, 줄기부분을 주로 사용하여 실험을 진행하였는데, 이는 백색집락형성 효모가 김치 저장 중 줄기부분에서 생육하기 때문이다. 멸균된 가위와 핀셋을 이용하여 김치를 6 well plate에 각 5 g씩 나누어 넣어주었다. 배양된 각 효모는 배양액 및 대사물질 제거를 위해 3,500×g에서 원심분리한 후 PBS 용액으로 현탁하여 세척하는 방식을 2번 반복하였으며, 마지막 원심분리에서 상층액을 제거하고, 침전된 효모를 키토산과 젖산 또는 키토산만 첨가된 수용액과 혼합하여 약 106 CFU/mL 농도까지 희석하였다. 이렇게 만들어진 효모 접종액을 미리 준비된 김치표면에 200 μL씩 분주하였다. 키토산이나 젖산이 전혀 첨가되지 않은 멸균된 증류수에 효모를 혼합하여 김치 표면에 같은 방식으로 200 μL씩 분주하여 대조군 실험을 진행하였다. 이렇게 준비된 김치는 10℃에서 12일간 보관하며 3일마다 시료를 취하였다. 각 김치 시료를 멸균된 stomacher bag에 넣고 PBS 45 mL를 분주하여 Stomacher (WiseMix® WES, DAIHAN Scientific, Wonju-si, Korea)을 이용하여 약 1분간 균질화를 실시했으며, 10배 희석법에 따라 PBS로 적절히 희석한 후 Dichloran Rose Bengal Chloramphenicol agar(DRBC; Oxoid, Basingstoke, UK)에 도말하여 25℃에서 48시간 배양 후 배지에 생성된 효모 집락수를 계수하였다.
Ⅲ. 결과 및 고찰
키토산은 D-글루코사민과 N-아세틸글루코사민을 한 단위로 연속적으로 β결합으로 연결된 선형다당류로 그 잔기에 존재하는 NH2가 산성 pH에서 양성자화(NH3+)되어 음전하를 띠고 있는 미생물의 세포막 인지질에 부착하여 세포막 기능을 저해하는 것으로 항균활성이 나타난다(17). 따라서 키토산은 pH가 낮은 환경에 존재할수록 양성자화된 NH3+의 수가 증가되고 키토산의 항균력은 더 강해진다. Chang 등(18)에 따르면 같은 분자량과 온도에서 pH가 낮아질수록 키토산의 제타전위 값이 증가함에 따라 양성자화된 NH3+가 많아지는 결과를 얻게 되었으며, S. aureus에 적용하여 생육억제력을 측정해본 결과, 그 효과가 증가하는 경향을 확인하였다. 마찬가지로 새우에서 얻어진 키토산을 낮은 pH에서 수용화시켜 E. coli에 적용했을 때 더 높은 항균 활성을 보여줌으로써(19) 키토산의 항균기작과 pH가 매우 밀접한 관계가 있다는 것을 알 수 있다. 따라서 본 연구에서는 키토산의 백색집락 형성 효모에 대한 항균력을 높여주기 위해 김치의 주요 유기산인 젖산을 이용하여 산성 pH 하에서 키토산을 1.0%의 농도로 맞춰 실험을 진행하였다.
키토산과 젖산을 첨가하여 조제한 YPD broth에 백색집락 형성 효모(WCFY) 3종(K. servazzii, P. kudriavzevii, H. uvarum)을 접종한 후 25℃에서 48시간 배양하며 측정된 생육변화를 Figure 1에 나타내었다. 접종한 효모의 초기 균수는 약 5.0∼6.0 log CFU/mL이고, 키토산과 젖산을 모두 첨가하지 않은 대조군은 24시간 후 약 7.0∼8.0 log CFU/mL까지 생육하였으며, 젖산만 첨가하여 pH를 약 4.5∼5.0으로 맞춘 YPD broth에서는 3종의 효모 모두 대조군과 유사하게 생육하였다. 본 연구결과와 마찬가지로 Kim 등(20)이 진행한 연구에 따르면 본 실험에서 사용된 균주와 같은 WCFY 3종에 대하여 염산을 사용하여 pH 3까지 낮추었을 때 효모의 생육속도가 조금 느려지지만 완전한 생육억제는 발생하지 않은 것을 확인하였다. 이는 발효된 김치에서 생육하는 WCFY의 경우, pH에 내성이 있어 낮은 pH만으로는 WCFY의 생육을 저해하기 어렵다는 사실을 알 수 있다.
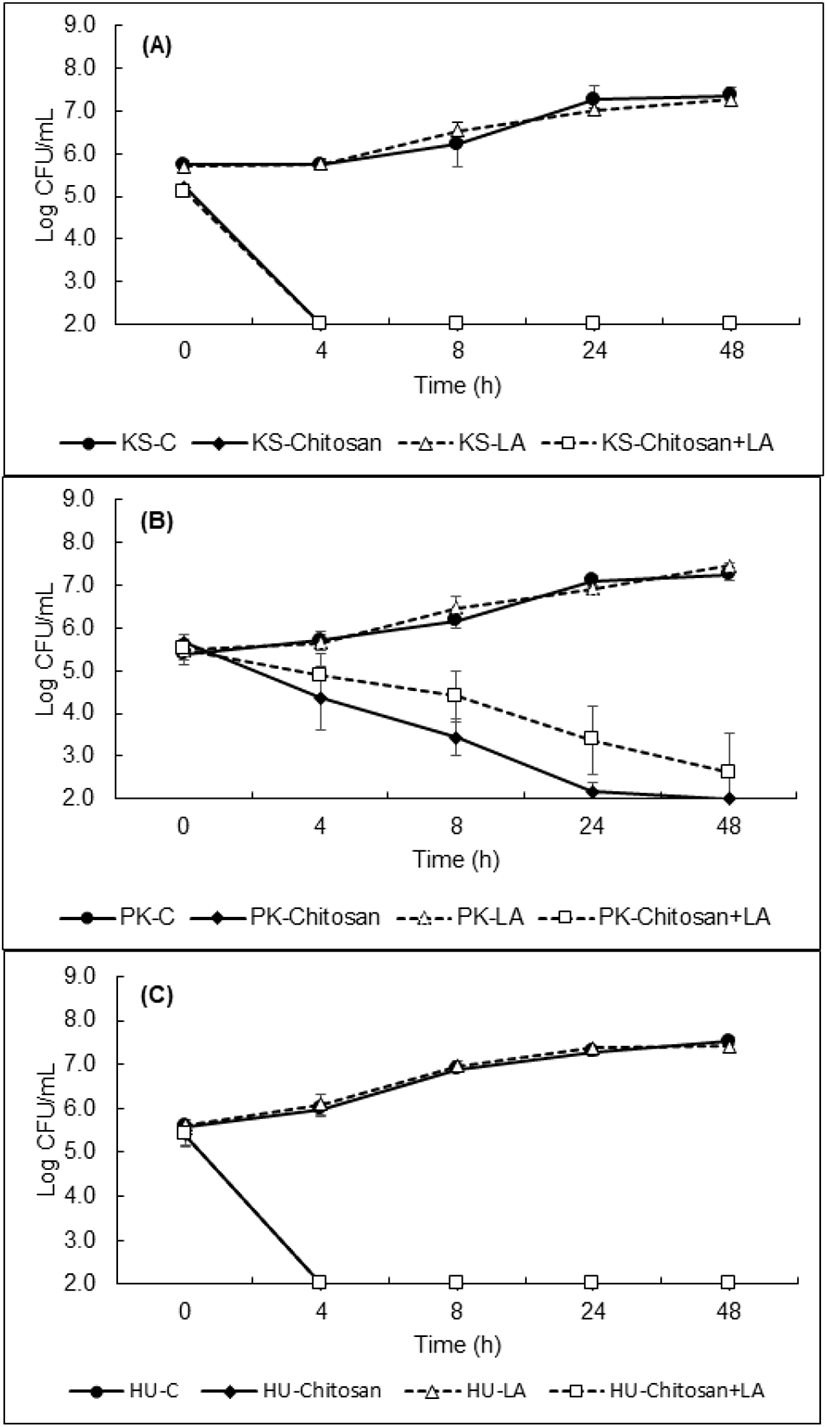
이와 달리 키토산 단독 또는 키토산과 젖산을 함께 첨가한 경우, K. servazzii과 H. uvarum 모두 4시간 경과 후 검출 한계까지 감소하였으며, P. kudriavzevii는 각각 24시간과 48시간 정도 후 검출한계까지 감소하였다(Figure 1). 하지만 본 연구에서는 젖산의 첨가 유무에 따른 키토산의 항균효과는 유의적인 차이가 없는 것으로 나타났다. 본 결과를 바탕으로 키토산 단독 또는 키토산과 젖산을 병용처리하여 김치에서의 WCFY의 생육 저해효과를 분석하였다.
본 연구는 신선한 김치의 저장성 향상 목적으로 진행되었기 때문에 상기에 언급한 방법대로 당일 만들어진 김치를 사용하여 김치의 발효조건을 동일하게 맞추어 주었다. 저장성 실험은 10℃에서 12일 동안 진행되었으며, 3일마다 시료를 취하여 키토산 단독 또는 키토산과 젖산의 병용처리가 김치에서 WCFY의 생육에 미치는 효과를 분석하였다(Figure 2). 김치에 접종된 효모의 초기균수는 약 5.0∼6.0 log CFU/g이었으며, 3종의 효모 모두 김치 표면에서 키토산 또는 젖산과의 병용처리가 없는 조건에서는 생육하여 12일째 되었을 때 약 8.0 log CFU/g까지 생육하였다.
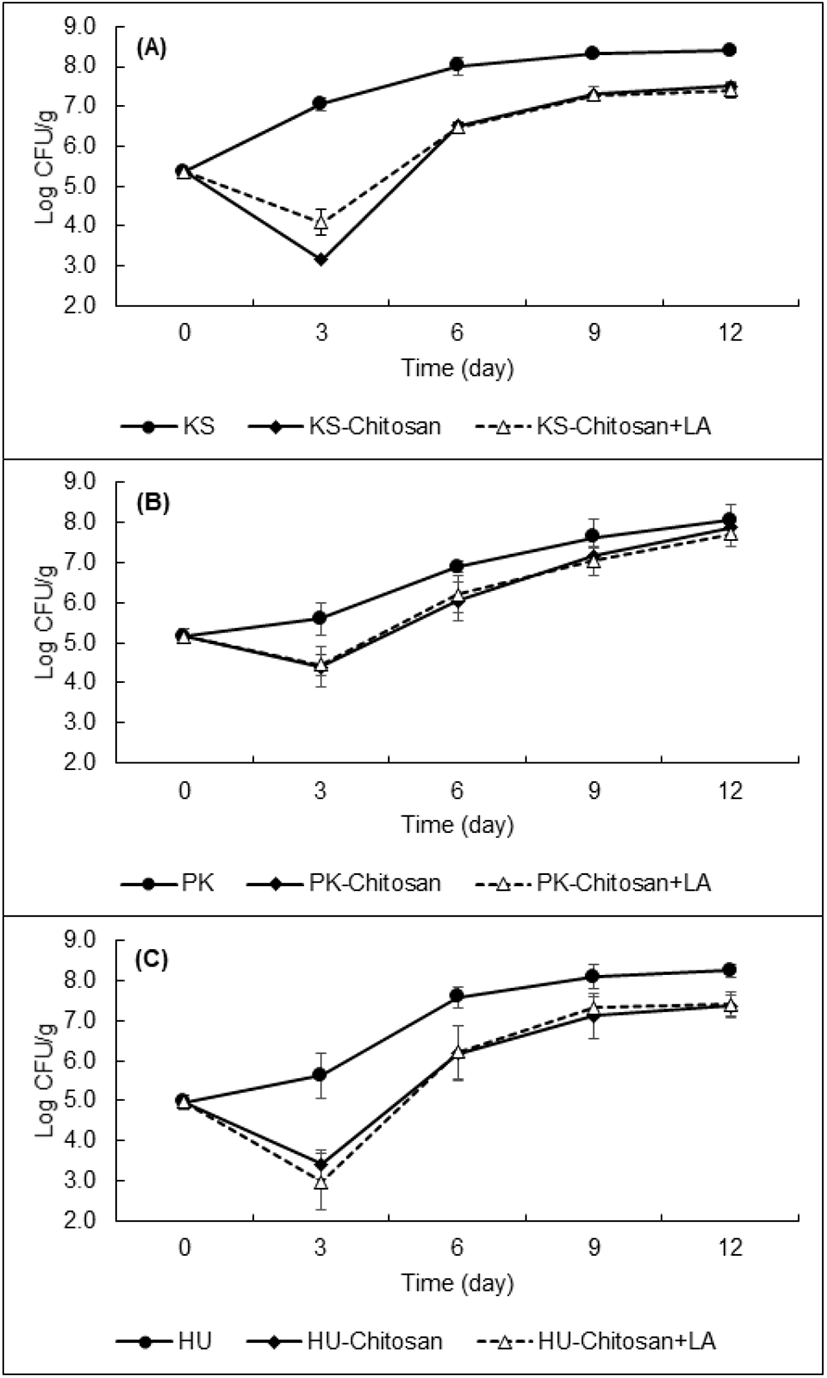
젖산 첨가 유무와 상관없이 키토산이 처리된 김치의 경우, K. servazzii와 H. uvarum는 저장 3일째까지 약 3.0 log CFU/g까지 감소하여 키토산 첨가 시 유의적으로 효모의 생육을 억제하는 것으로 나타났다(Figure 2). 하지만 3일째 이후 꾸준히 생육하여 12일째 약 7.4 log CFU/g까지 증가하였다. 하지만 대조군에 비해 효모균수가 약 1.0 log CFU/g 정도 유의적으로 낮은 것으로 나타나 이 두 효모 균주에 대한 키토산의 생육저해 효과는 있는 것으로 판단된다. P. kudriavzevii의 경우, K. servazzii와 H. uvarum과 유사하게 첫 3일째까지 감소하는 경향을 보이다가 이후 생육하여 12일째에는 약 7.7 log CFU/g까지 증가하여 대조군과 유의적인 차이가 없었다. 따라서 P. kudriavzevii에 대해서는 키토산 단독 또는 키토산과 젖산의 병용처리의 생육저해 효과가 없음이 확인되었다. 또한, YPD broth에서 수행한 결과와 마찬가지로 3종의 WCFY 모두 키토산의 생육저해 효과에 있어서 젖산 첨가에 따른 유의적인 차이를 확인하지 못하였다. 본 연구결과와 유사하게 Roller 등(21)이 진행한 연구에 따르면 비살균 사과주스(pH 3.4)에 키토산을 첨가하여 부패 효모의 생육을 관찰한 결과, 저장 초기에는 효모의 생육을 억제하였지만, 일정 시간이 지남에 따라 대조군과 비슷하게 생육하는 것을 확인하였다. 따라서 이러한 결과는 키토산의 효모에 대한 항균효과가 일시적이며, 저장기간 동안 지속적인 항균효과를 유지하기 위해서는 키토산의 농도를 높이거나 혹은 다른 항균물질을 병용처리할 필요가 있음을 보여준다.
Ⅳ. 요약 및 결론
본 연구에서는 김치에서 골마지를 형성하는 백색집락 형성 효모(WCFY)의 생육을 억제하기 위해 천연항균물질인 키토산과 젖산의 병용처리 효과를 분석하였다. 키토산 단독 또는 키토산과 젖산의 병용처리의 항균 효과를 YPD broth에서 확인하기 위해 WCFY 3종(K. servazziiP. kudriavzevii, H. uvarum)의 효모를 각각 배지에 접종한 후 키토산을 처리했을 때, P. kudriavzevii를 제외한 2종은 4시간 만에 검출한계까지 감소하였으며, 24시간 뒤에는 P. kudriavzevii 또한 검출한계까지 감소하여, YPD broth에서는 키토산의 항균효과가 확인되었다. 또한, 효모 종류에 따라 키토산 또는 키토산과 젖산의 병용처리 효과가 다르게 나타나, 효모 균주별로 키토산에 대한 민감성이 다르다는 사실을 알 수 있었다. 반면에, 김치에 키토산 단독 또는 키토산과 젖산을 병용 처리했을 때 3종의 효모 모두 첫 3일째까지 감소하다가 3일 이후에는 대조군과 유사한 속도로 증식하여 12일째 K. servazzii와 H. uvarum은 대조군에 비해 약 1.0 log CFU/g 적었으며, P. kudriavzevii는 대조군과 유의적인 차이가 없었다. 본 연구 결과, 키토산의 백색집락 형성 효모의 생육 억제에 대한 가능성을 확인하였지만, 김치의 저장기간 동안 지속적인 항균 효과를 유지하기 위해서는 키토산의 농도와 함께 다른 항균물질의 병용처리 효과에 대한 추가적인 연구가 필요할 것으로 여겨진다.
