Article
유산균 발효 황금 추출물의 황산화 활성
민동규1, 조항혁1, 권상철1,*
Antioxidant Activity of Lactobacillus Fermented Scutellaria baicalensis Extract
Dong-Gyu Min1, Hang-Hyuk Jo1, Sang-Chul Kwon1,*
Author Information & Copyright ▼
1충청북도 증평군 대학로 61 한국교통대학교 보건생명대학 식품생명학부 식품공학전공 27909
1Department of Food Science and Technology, Korea National University of Transportation, Jeungpyeong 27909, Korea
© Copyright 2023 Institute of Biotechnology and Bioindustry. This is an Open-Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Oct 25, 2023; Revised: Nov 24, 2023; Accepted: Dec 08, 2023
Published Online: Dec 31, 2023
ABSTRACT
This study was conducted to examine the antioxidant activity of the ferments from Scutellaria baicalensis extracts by lactic acid bacteria to confirm the possibility for the development of functional sources. After the production of Scutellaria baicalensis extract, fermentation was carried out for 3 days through 3 Lactobacillus (Lactobacillus paracasei, Lactobacillus plantarum, Leuconostoc mesenteroides) to finally prepare 3 fermentation extracts. During the fermentation period, pH decreased, and the total polyphenol content was significantly higher at 38.57±0.87 mg GAE/g of the fermented Scutellaria baicalensis extract of Lactobacillus paracasei, and the total flavonoid content was also significantly higher at 33.21±5.62 mg CE/g in the fermented Scutellaria baicalensis extract of Lactobacillus paracasei. In the case of DPPH radical scavenging ability, the Lactobacillus paracasei fermented Scutellaria baicalensis extract was significantly higher at 67.83±0.41%. Therefore, this study shows the possibility that the fermentation of the Scutellaria baicalensis extract can be used as a functional material of a functional sauce.
Keywords: fermented; antioxidant; Scutellaria baicalensis; functional; sauce
Ⅰ. 서 론
황금은 다년생 쌍떡잎식물 통화 식물목 꿀풀과에 속해 있고 중국이 원산지이며 한국, 중국, 시베리아 등지에서 자생 또는 재배되고 있다(1, 2). 여러해살이풀로 높이는 20~26 cm에 달하고, 자금, 조금, 편금 등으로 불리며 그 맛은 쓰고 성질은 차갑고 무독성이며, 주로 뿌리를 약용한다(3, 4). 황금은 한방에서 소염, 해열, 변비, 위장염, 알레르기 및 천식의 치료로 사용되어 왔으며 약리작용으로는 항천식작용, 항암작용, 항균작용, 항산화 활성, 항고지혈 효과, 생체보호작용, 면역조절기능 등이 보고되어 있다(4, 5).
황금의 성분으로는 flavonoid계 화합물로서 30여 종이 분리되어 있는데, baicalein, biacalin, chrysin, oroxylin-A, oroxylin-α-7-o-glucuronide, wogomin, wogonoside, wogonin glucuronide, neo-baicalein, koganebananin, 5,7,2’6’-tetrahydroxyflavone, skullcapflavone, dihydrobaicalin 등 수종의 플라보노이드를 함유하고 있다(4). 이러한 수종의 플라보노이드를 함유한 황금은 상기 유효 성분들이 지니는 기능성으로 간세포 보호, 간경화 억제, 알코올로 인한 위 손상 억제, 위산 억제, 헬리코박터 파일로리균 억제, 관절 등의 통증완화 효과 등의 효능에 대한 연구들이 진행되고 있다.
Free radical은 superoxide radical, hydrogen peroxide, hydroxy radical과 같은 활성산소증이 있다. 활성산소증은 외부로부터 침입하는 세균을 대식세포가 제거하는 과정 등 정상적인 역할을 담당하고 있으나 이러한 물질들이 체내 과도하게 생성됨으로 산화 스트레스 및 반응이 일어날 경우 세포막의 파괴와 유전자 손상, 염증과 노화, 돌연변이, 암 등의 질환을 유발한다(6, 7).
천연물이 가진 성분이나 소재의 활용성을 증진시키기 위해 유용한 미생물을 이용한 발효의 방법은 다양한 분야에서 연구되어 왔다. 발효에 미치는 미생물은 유산균, 세균, 효모 등이 있으며 유산균의 같은 경우 발효 공정 개발에 자주 활용되고 있다(5). 이와 같은 유산균을 이용한 방법이 천연물의 기능성인 항산화, 항균 등의 증가에 영향을 미치는 다양한 연구가 진행되어 왔으며, 발효 공정은 최종 대사산물의 성분의 변환 혹은 천연물의 생리활성 효과를 극대화할 수 있고, 천연물과 미생물 상호 간의 상승효과에 의한 생리활성 효능이 증가될 수 있다(8).
최근 서구화된 식생활과 신체활동 감소로 생활습관병이 발병하여 건강에 대한 관심이 높아지고 있으며 이에 식품의 기능성에 대한 관심도가 높아지고 있다. 현재 시판되고 있는 소스 대부분의 소스류는 편리성과 풍미 증진을 목적으로 개발되었기 때문에 합성조미료 등 식품첨가물의 사용이 일반적이다. 따라서 천연재료에 함유된 생리활성물질을 이용함으로써 질병 예방 및 건강증진 기능성을 갖는 기능성 소스를 개발하려는 시도가 이루어지고 있다(9). 최근에도 기능성과 보존성을 높인 소스의 개발은 최근까지도 다양한 종류의 천연물을 가공함으로써 활발하게 이루어지고 있다(9–11).
그러나 황금을 첨가한 소스의 개발에 대한 연구에서 황금에 대한 연구로는 추출방법, 발효, 항균, 항산화 등 다양한 논문이 있고, UM 등의 연구에서 유산균을 발효한 황금의 연구에서는 한가지의 유산균만을 사용하여 발효하여 항산화능을 비교하였기에, 보다 많은 유산균을 활용한 발효에 대한 연구는 미비한 실정이다.
따라서 본 연구에서는 3종의 유산균을 황금추출물에 유산균 발효하고, 발효된 전후의 황금의 항산화 효능을 분석하였으며, 황금이라는 천연물에 가장 활성이 높은 유산균과 항산화 능의 증가를 평가한다.
II. 재료 및 방법
1. 실험재료
본 연구에서 사용한 황금은 시중에서 황금분말을 구입하여 −20°C에서 보관하며 사용하였다. 황금 추출물 제조는 황금 원물을 분말시료 30 g에 증류수 300 mL를 가하여 환류냉각추출(reflux extraction, RE)을 이용하여 80°C에서 3시간 동안 추출하였다. 추출물은 200 mesh로 여과한 후 여과지(advantec No.2, Toyo Roshi Kaisha, LTD., Japan)로 감압여과하고 회전 감압 농축기(N-1000, Eyela, Japan)를 사용하여 농축하며 −80°C에서 냉각 후 동결건조기(FD8508, Ilshinbiobase Co., Korea)를 이용하여 동결건조하여 분말 상태로 −80°C에서 보관하면서 시료로 사용하였다. 이후 분말을 증류수에 2%로 희석하여 시료로 사용하였다.
2. 유산균 발효물 제조
사용한 유산균으로는 한국교통대학교 식품생명학부에서 분양받은 Leuconostoc mesenteroides MGE3138(L.m), Lactobacillus plantarun MGE3143(L.pl), Lactobacillus paracasei MGE3016 (L.pa) 균주를 사용하였으며, 백금이로 각각 한 집락 채취해 MRS Broth(Difco Co., USA) 배지에 1차 접종 후 37°C, 24시간 배양 후, 10 mL MRS Broth에 다시 1%를 2차 접종 후 37°C, 24시간 증균배양을 실시하였다. 황금추출물에 유산균 배양액을 각각 2%씩 접종하고 37°C, 72시간 발효를 진행하였다. 이는 항산화 활성이 발효 3일에 가장 큰 활성을 가진다는 Lim의 연구(12)에 따라 발효하였다. 발효 후 autoclave로 121°C, 15분 열을 가하여 유산균의 실활을 유도하였으며, 동결건조기(FD8508, ilshin biobased, Korea)로 동결건조해 분말화 하여 −80°C에 보관하면서 시료로 사용하였다.
3. pH
pH 측정은 pH meter(FP20, METTLER TOLEDO, Greifensee, Switzerland)를 이용하여 발효를 진행하는 3일 동안 Homogenizer(MS-HS320, IKA, USA)로 1,300 rpm에서 5분간 균질화하여, 3회 반복 측정하였다.
4. 총 폴리페놀 함량
총 폴리페놀 함량은 Kim 등의 방법(13)을 일부 변형하여 측정하였다. 시료 4 mL에 0.2 N Folin-Ciocalteu’s phenol reagent 시약(Sigma-Aldrich, USA)을 4 mL, 2 % Na2CO3 용액 4 mL를 가하고 실온 암소에서 1시간 반응시켰다. 반응 후 spectrophotometer(Optizen POP, Mecasys Co., Korea)를 이용하여 750 nm 파장에서 흡광도를 측정하였다. 대조구는 gallic acid(Sigma-Aldrich, USA)를 농도별로 희석하고, 표준곡선을 작성하여 시료 중의 총 폴리페놀 함량을 정량하여 gallic acid equivalents(mg GAE/g)로 환산하여 나타냈다.
5. 총 플라보노이드 함량
총 플라보노이드 함량은 Lee 등의 방법(14)을 이용하여 측정하였다. 시료 5 mL에 5% sodium nitrite 0.75 mL를 혼합하여 실온에서 6분간 반응시킨 후 10% aluminium chloride 1.5 mL를 첨가하고, 실온에서 5분간 반응시킨 다음 1 N NaOH 5 mL와 혼합한 후 spectrophotometer를 이용하여 510 nm에서 흡광도를 측정하였다. 총 플라보노이드 함량은 (+)- catechin hydrate(Sigma-Aldrich, USA)를 농도별로 희석하고, 표준곡선을 작성하여 catechin equivalents(mg CE/g)로 환산하여 나타냈다.
6. DPPH 라디칼 소거능 측정
DPPH(2,2-diphenyl-1-picrylhydrazyl)에 대한 radical 소거능은 DPPH의 환원력을 이용하여 측정하였다(15). 즉 시료 1 mL에 0.2 mM DPPH 용액(99.9 % ethyl alcohol) 용해 후 9 mL를 가하고 10초간 혼합한 후 실온암소에서 10분간 반응시키고, spectrophotometer를 이용하여 517 mm 파장에서 흡광도를 측정하였다. 이때 전자공여능은 시료 첨가군과 시료 무첨가군의 흡광도 차이를 백분율(%)로 구하였다.
7 통계처리
모든 실험은 3회 이상을 반복 실험을 시행하였으며, 얻어진 결과는 SPSS(Statistical package for the social science 18.0) program을 사용하여 Duncan’s multiple range test를 실시하였다. 통계적 유의성 검증은 p<0.05 수준에서 유의적 차이를 확인하였다.
Ⅲ. 결과 및 고찰
1. pH
황금 추출물의 유산균 발효에 따른 pH 변화는 Table 1에 나타내었다. 본 실험의 결과 L. mesenteroides, L. plantarum, L. paracasei 3종류의 발효 추출물 모두 시간이 지남에 따라 pH가 점차적으로 감소하는 것을 확인하였다. 그 중 Lactobacillus paracasei 발효 추출물의 경우, 0시간 5.76±0.01, 24시간 4.08±0.01, 48시간 3.80±0.01, 72시간 3.84±0.00으로 가장 큰 감소 폭을 보였으나 배양 48시간 이후로는 큰 변화를 보이지 않았다. 이러한 pH 변화의 원인은 미생물이 당을 이용해 유기산을 생성하고, 효소 가수 분해에 의한 아미노산, 펩타이드, 유리지방산 등의 증가로 인한 수소이온농도가 증가하는 것으로 보고된 바 있다(16). 또한 황금 발효 추출물의 pH가 감소하는 결과는 Bae(17) 등의 연구와 유사한 경향을 나타내었다.
Table 1.
Changes in pH of fermented Scutellaria baicalensis extraction liquid with lactic acid bacteria
| pH |
Times (h) |
| 0 |
24 |
48 |
72 |
| Non-fermented |
5.77±0.05 |
5.50±0.02 |
5.2±0.02 |
4.45±0.02 |
|
Leuconostoc mesenteroides
|
5.72±0.01 |
5.52±0.01 |
5.42±0.02 |
4.74±0.00 |
|
Lactobacillus paracasei
|
5.76±0.01 |
4.08±0.01 |
3.80±0.01 |
3.84±0.00 |
|
Lactobacillus plantarum
|
5.90±0.02 |
4.37±0.01 |
4.31±0.01 |
4.28±0.01 |
Download Excel Table
2. 총 폴리페놀 함량
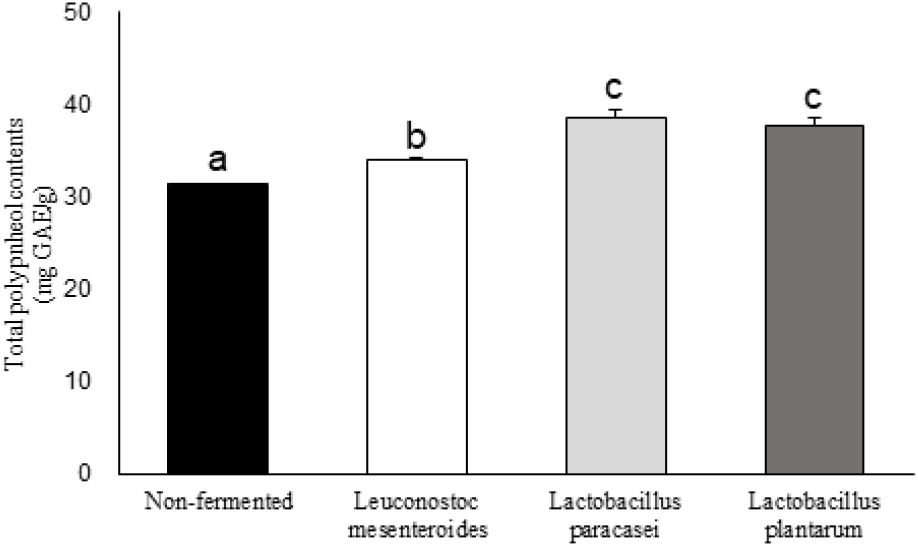
유산균 발효에 따른 황금 추출물의 총 폴리페놀 함량은 Figure 1에 나타내었다. 페놀성 화합물은 항산화 작용을 하여 체내 조직을 보호할 뿐만 아니라 생리적 효율성을 높임으로써 페놀 화합물의 함량이 많을수록 항산화 활성이 높다고 알려져 있다(18). 유산균에 따른 발효물의 총 폴리페놀 함량은 L. paracasei 발효 황금 추출물이 38.57±0.87 mg GAE/g으로 가장 높았으며 L. plantarum 37.64±0.92 mg GAE/g, L. mesenteroides 34.02±0.16 mg GAE/g 순으로 나타났다. 비발효 황금 추출물과 비교하여 유산균 발효 황금 추출물의 경우 유의적으로 높은 총 폴리페놀 함량을 나타내었는데, Kim 등(19)의 기존 연구에 따르면 미생물에 의한 생물전환을 통해 총 폴리페놀 함량 변화에 영향을 줄 수 있다고 한다. 따라서 발효한 황금 추출물의 총 플라보노이드 함량의 증가 원인은 L. mesenteroides, L. plantarum, L. paracasei의 대사과정을 통해 이루어졌을 것으로 판단된다.
Figure 1.
Total polyphenol content of fermented Scutellaria baicalensis extraction.
a-c superscripts are significantly different at p<0.05 by Duncan’s multiple range test.
Download Original Figure
3. 총 플라보노이드 함량
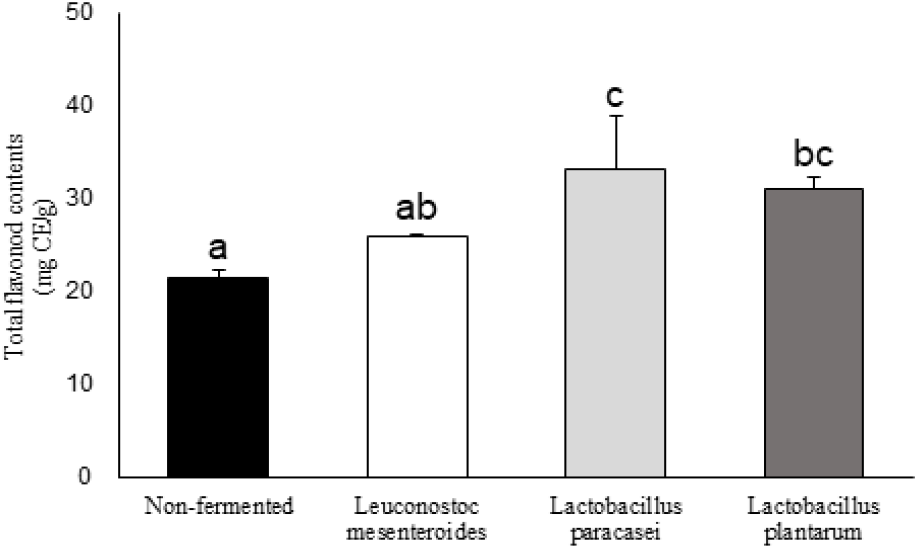
유산균 발효에 따른 황금 추출물의 총 플라보노이드 함량은 Figure 2에 나타내었다. 비발효 황금 추출물의 경우 21.49±0.81 mg CE/g을 보였으며, L. paracasei은 33.21±5.62 mg CE/g, L. plantarum 30.99±1.28 mg CE/g, L. mesenteroides 25.87±0.22 mg CE/g으로 나타났다. 총 플라보노이드 함량 또한 유산균 발효 황금 추출물에서 유의적으로 높은 함량을 나타내었으며, 폴페놀 함량과 유사한 결과를 보였다. 플라보이드는 폴리페놀의 일종이며, 폴리페놀 함량이 증가하면 항산화 등과 같은 생리활성 또한 비례적으로 증가한다고 보고되고 있다(20). 본 실험결과는 이전 연구에서 L. mesenteroides를 이용한 사물탕 발효물의 총 폴리페놀 및 플라보노이드 함량이 발효에 따라 증가하는 결과와 유사한 경향을 보이는 것을 확인하였다(21).
Figure 2.
Total flavonoid content of fermented Scutellaria baicalensis extraction.
a-c superscripts are significantly different at p<0.05 by Duncan’s multiple range test.
Download Original Figure
4. DPPH radical 소거능
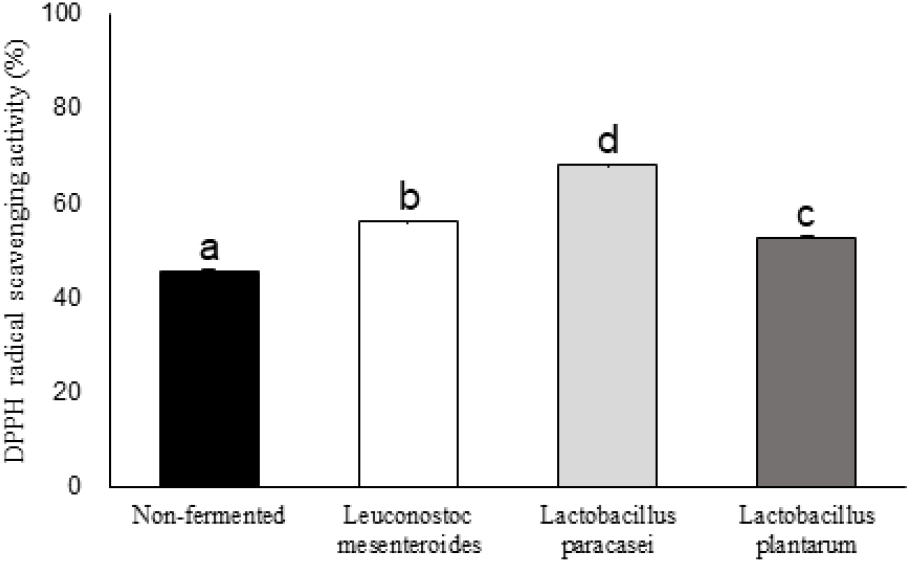
유산균 발효에 따른 황금 추출물의 DPPH radical 소거능은 Figure 3에 나타내었다. DPPH radical 소거능은 L. paracasei은 67.83±0.37%, L. mesenteroides 56.06±0.10%, L. plantarum 52.40±0.51%, non-fermented 45.30±0.54% 순으로 나타났다. L. paracasei은 67.83±0.37% 발효 황금 추출물이 다른 발효물에 비해 유의적으로 높은 DPPH radical 소거능을 보였는데, 이는 기존 Maisuthisakul 등(22)의 연구에 따르면 폴리페놀 및 플라보노이드 화합물은 불안정한 라디칼에 전자를 공여함으로써 라디칼을 소거한다고 한다. 따라서 페놀성 화합물과 Radical 소거능과 높은 상관관계를 지녀 다음과 같은 결과를 나타낸 것으로 보여진다. 또한, DPPH radical 소거능을 Shin(23)의 미더덕 껍질, 뽕잎, 양파의 추출물을 함유한 발효소스 제조 실험 결과와 비교하였을 때 높은 DPPH radical 소거능을 지니고 있으므로 활용 가능성이 높다고 보여진다.
Figure 3.
DPPH scavenging activity of fermented Scutellaria baicalensis extraction.
a-c superscripts are significantly different at p<0.05 by Duncan’s multiple range test.
Download Original Figure
Ⅳ. 결 론
기능성 증진 소스 개발 위해 황금(Scutellaria baicalensis) 추출물을 다양한 유산균(Leuconostoc mesenteroides, Lactobacillus plantarum, Lactobacillus paracasei)을 통해 발효한 뒤 항산화 활성을 비교하고자 하였다. 3종류의 유산균을 통해 발효를 마친 황금 발효 추출물의 항산화 성분 함량과 DPPH 라디칼 소거능을 검토하여 기능성 물질로서의 가능성을 확인하였다. 먼저, pH 변화의 경우 Lactobacillus paracasei 발효 추출물의 경우 0시간 5.76±0.01, 72시간 3.84±0.00으로 가장 큰 변화를 보였으며, Total polypnheol contents의 경우 Lactobacillus paracasei 유산균 발효 황금 추출물이 38.57± 0.87 mg GAE/g으로 유의적으로 높은 항산화 성분을 보이고 있었다. 이와 마찬가지로 Total flavonoid contents 또한 Lactobacillus paracasei 유산균 발효 황금 추출물이 33.21± 5.62 mg CE/g으로 유의적으로 높게 나타났다. 마지막으로 DPPH 라디칼 소거능 또한 Lactobacillus paracasei 발효 황금 추출물이 67.83±0.41%로 유의적으로 높은 라디칼 소거능을 보이고 있음을 확인하였다. 결론적으로 L. paracasei 발효 황금 추출물은 항산화 활성이 다른 유산균 및 비발효 황금 추출물에 비해 높은 항산화 활성을 보이고 있음으로 기능성 물질로서의 기능성 소스 개발의 가능성을 보여주었다.
사사
이 논문은 2023년도 한국교통대학교 교내학술연구비의 지원을 받아 수행한 연구임.
참고문헌
Cho SH, Kim YR. (2001) Antimicrobial characteristics of scutellariae radix extract. J Korean Soc Food Sci Nutr. 30, 964~8.

Kim NY. (2014) Effect of antioxidation and inhibition of melanogenesis from
Scutellaria baicalensis extract. Kor J Aesthet Cosmetol. 12, 41~7.

Park CS, Kim DH. (2008) Biological activities of extraxts from
Scutellaria baicalensisZizyphus jujuba and
Atractylodes macrocephala. Kor J Herbology. 23, 41~51.

Choi MR, Lee JS, Lim HS. (2007) Changes in physiological activities of
Scutellariae baicalensis by heating. J Life Sci. 17, 1381~6.


Um JN. (2017) Enhancement of antioxidant and whitening effect of fermented extracts of
Scutellariae baicalensis. J Soc Cosmet Sci Korea. 43, 201~10.


Lim MJ, Gu YR, Hong JH. (2019) Extraxtion solvent-dependent antioxidant activities and cancer cell growth inhibitory effects of
Scutellaria baicalensis extraxts. Korean J Food Preserv, 26, 566~75.


Kim SI, Moon JY, Kim KS, Kim DH, Nam KS. (1997) Antioxidative effects of
Scutellariae radix aaquaacupuncture solution on lipid peroxidation induced by free radicals. J Soc Prev Korean Med. 1, 48~54.

Choi WS, Kwon HS, No RH, Choi GP, Lee HY. (2013) Enhancement of anti-inflammatory activities of fermented
Scutellaria baicalensis extraxts using
Lactobacillus rhamnosus. J Soc Cosmet Sci Korea. 39, 303~11.


Oh HS, Kim JH. (2006) Development of functional soy-basedstew sauce including hot water extract of
Cornus officinalis S. et Z. Korean J Food Culture. 21, 550~8.

Jumg Y, Park SY, Park SH, Yeom ES, Jeong WY. (2023) Antioxidant and antibiotic activities of seasoned soy sauce added with medicinal mushrooms and oriental medicinal plants. Korean J Food Nutr. 36, 33~41.

Kim HS, Hwang TY, Ahn JJ. (2015) Antioxidant activity and quality characteristics of stew sauce mixed with
Smilax china L. extract during storage. Korean J Community Living Sci. 26, 489~98.


Park SJ, Oh DH. (2003) Free radical scavenging effect of seed and skin extracts of Black Olymipia grape. Korean J Food Sci Technol. 35, 121~4.

Jeong GJ, Kim ST, Park JG, Kim KH, Kim KM. (2017) Antioxidant activities and protective effects of hot water extract from
Curcuma longa L. on oxidative stress-induced C2C12 myoblasts. Korean Soc Food Sci Nutr. 46, 1408~13.

Lee DH, Hong JH. (2015) Physicochemical properties and storage stability of blueberry fermented by lactic acid bacteria. Korean J Food Preserv. 22, 796~803.


Blois MS. (1958) Antioxidant determinations by use of a stable free radical. Nature. 181, 1199~200.


Yang SJ, Hong JH. (2016) Physicochemical characteristics and biological activities of fermented quinoa according to fermentation times. J Chitin Chitosan. 21, 188~96.


Bae JH. (2005) The effect of fermented extracts of
Portulaca oleracea against
Campylobacter jejuni. Korean J Food Nutr. 25, 291~8.


Duval B. (2007) The stimulation of phenolics and antioxidant activyi in pea (
Pisum sativum) elicited by genetically transformed anise root extract. J Food Biochem. 25, 361~77.


Kim BH, Jang JO, Lee JH, et al. (2019) Evaluation of the anti-oxidant activity of pueraria extract fermented by
Lactobacillus rhamnosus BHN-LAB 76. J Life Sci. 29, 545~54.

Um JN, Min JW, Joo KS, Kang HC. (2017) Antioxidant, anti-wrinkle activity and whitening effect of fermented mixture extracts of
Angelica gigas,
Paeonia lactiflora,
Rehmannia chinensis and
Cnidium officinale. Korean J Med Crop Sci. 25, 152~9.


Maisuthisakul P, Suttajit M, Pongsawatmanit R. (2007) Assessment of phenolic content and free radical-scavenging capacity of some Thai indigenous plants. Food Chem. 100, 1409~18.


Shin YJ, Kim MH, Lee CK, et al. (2015) Preparation of fermented sauces with increased ACE inhibitory and antioxidative activities. J Korean Soc Food Sci Nutr. 44, 1538~42.