Ⅰ. 서 론
화장품 보존제인 클로페네신(CPN)은 우수한 항균 및 항진균 효능으로 인해 미생물 성장을 억제하여 소비자 안전을 보장하는 핵심 성분으로 화장품 및 개인 위생용품(personal care products)에 널리 사용되는 합성 보존제이다. 그러나 CPN은 규정된 허용 농도 범위 내에서조차 다른 일반적인 보존제들에 비해 더 강한 피부 자극을 유발하는 것으로 나타났다. 실제로 CPN을 포함한 널리 쓰이는 보존제들이 인체 피부 세포에 미치는 유해한 영향(in vitro 실험 결과)은, 이러한 물질의 안전성을 높이기 위해 구조 변형(modification) 기술이 필요함을 시사한다. 당화 반응(glycosylation)은 저분자 화합물의 생체 친화적 특성과 용해도를 개선하는 매우 효과적인 방법이다. 본 실험에서는 크로마토그래피 분석을 통해, β-galactosidase(효소)를 이용한 당전이 반응으로 클로페네신 갈락토사이드(CPN-gal)가 성공적으로 합성되었음을 확인하였다. 특히 고성능 액체 크로마토그래피(HPLC)는 클로페네신의 정확한 정량 분석에 유용하며, 기존 물질(standard)과 변형된 물질(modified compounds)을 비교하는 데 최적화된 분석법이다. 결과적으로 이 연구에서 클로페네신은 효소를 통해 당화되었으며, 그 특성은 TLC와 HPLC로 규명되었다. 반응 48시간 후 관찰된 크로마토그래피 상의 거동 차이(피크 변화 등)는 당 결합(sugar conjugation)이 성공적으로 이루어졌음을 입증해준다.
Ⅱ. 본 론
실험에 사용된 클로페네신 표준물질은 UNILAB사의 클로페네신(Cas. No. 104-29-0)을 사용하였다. 분석 및 정제를 위해 Merck KGaA사의 TLC plate는 Silica gel 60 F254와 Merck Millipore사의 Silica gel 60(0.040∼0.063 mm)을 사용하였다. PBS 용액은 Sigma-Aldrich(USA)사의 Phosphate buffered saline tablet 1정을 증류수:에탄올=1:1(v/v)에 녹여 사용하였다. 용매인 ethyl alcohol, ethyl acetate는 대정(Siheung, Korea), acetonitrile은 삼전(Seoul, Korea) 제품을 사용하였다. 분석을 위해 사용된 HPLC는 Waters사의 e2695 모델을 사용하였다.
araBAD 프로모터 시스템이 적용된 pBAD/Myc-His/lacZ 벡터(Invitrogen)를 이용하여 숙주 세포인 E. coli MC1061에서 β-Gal을 발현 및 확보하였다. CPN-gal 생합성을 위해 500 mL 삼각 플라스크에 CPN 3.68 g과 Lactose 60 g을 50 mM PBS pH 7.0에 녹여 최종 부피를 200 mL로 채워준다. 이후 2,400 unit의 β-galatoside를 넣고 incubator에서 37°C 200 rpm 48 h로 반응시킨다.
TLC palte에 1.5 μL CPN, Lactose, CPN 반응물을 loading하여 CPN-gal이 생합성되었는지를 확인하였다. 전개용매는 아세토니트릴:증류수=93:7(v/v)를 사용하여 15분간 전개를 진행하였다. Starting solution(1.5 g KMnO4, 10 g K2CO3, 1.25 mL 10% NaOH in 200 mL water)를 이용하여 TLC plate를 염색한 후 드라이기를 이용하여 말린 후 Latose, CPN, CPN 반응물 spot을 확인하였다. Figure 1에서 보이는 바와 같이 48 h 반응 후 CPN-gal이 합성된 것을 확인하였다.
반응 종류 후, 반응액에 존재하는 CPN starting을 제거하기 위해서 에틸아세테이트를 이용한 용매 추출을 수행하였다. 250 mL 분별깔때기에 CPN 반응액과 에틸아세테이트를 1:1로 넣고 섞어준 후 층 분리를 유도하였다. 반응액 층과 에틸아세테이트 층으로 분리 후 두 용액을 각각 TLC plate에 3 μL loading 해준다. 분석 결과 starting 물질인 CPN의 경우 에틸아세테이트층에 확인되었고, 반응물 층에는 CPN-gal과 당이 있는 것을 확인하였다. 남아 있는 당은 당 침전을 통해 제거해 주었다. 반응액 층에 EtOH:ACN=2:1(v/v)를 첨가하여 교반기를 통해 희석 후 당을 침전시킨다. 침전된 당을 침전시켜 제거한 뒤, 반응액을 라운드 플라스크에 담아 회전식 감압 농축기(rotary evaporator)를 이용하여 농축시킨 후, 위 당 침전 방법을 반복한다. 이후 TLC 분석을 통해 당이 어느 정도 제거되었음을 확인하였다.
반응액 내 잔여 당을 제거하고 CPN-gal을 분리하기 위해 실리카겔 칼럼 크로마토그래피를 수행하였다. 이때 전개 용매로는 아세토니트릴:증류수=93:7(v/v)를 사용하였다. 크로마토그래피를 통해 획득한 CPN-gal 용액을 감압 농축기를 이용하여 분말 형태의 최종 생성물 7.5% 수율을 획득하였다.
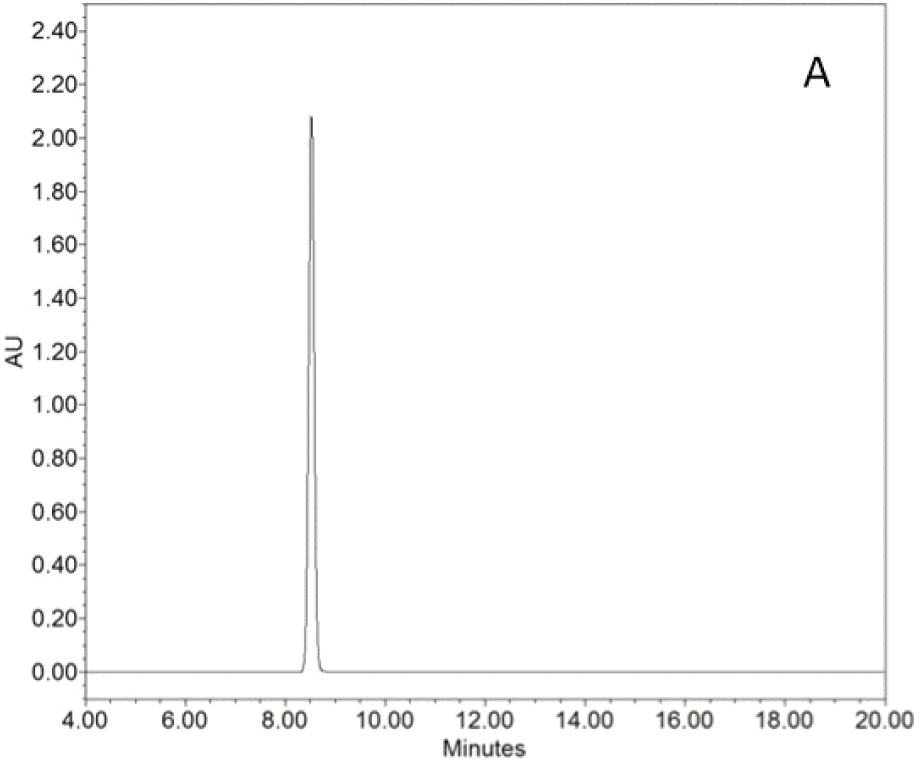
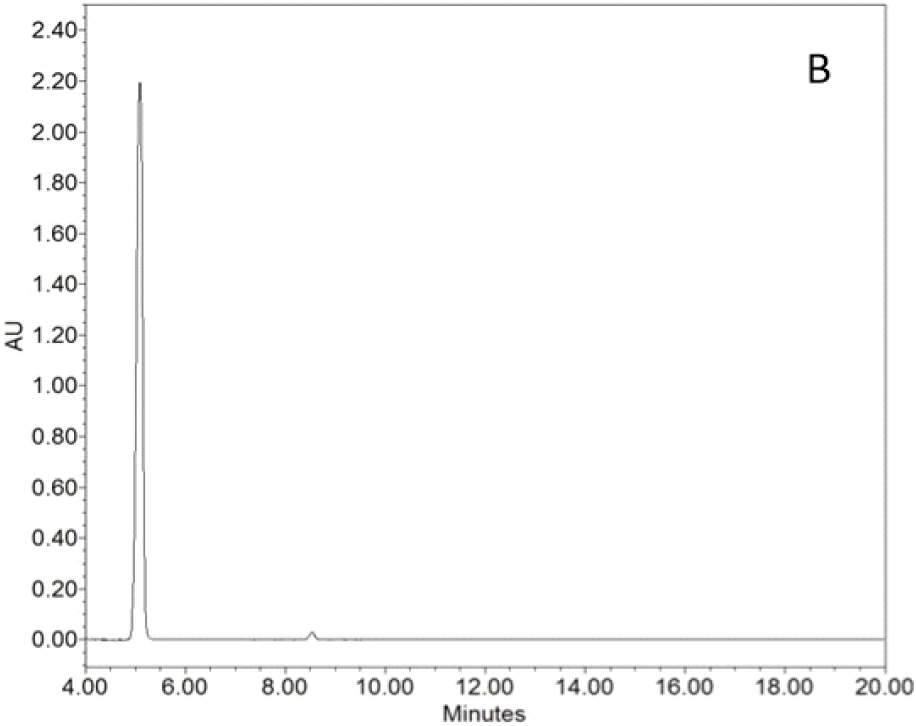
최종 분리 및 정제 과정을 거친 CPN-gal의 생합성을 확인하기 위해 표준 물질인 CPN(UNILAB사 제품)과 비교 분석을 수행하였다(Table 1). 두 시료는 동일 농도 0.5 mg/mL를 이용하여 HPLC로 분석하였다. Figure 2에서 보이는 바와 같이 표준 물질인 CPN의 용리시간은 8.5분인 반면, Figure 3에서 CPN-gal의 용리시간은 5분에서 피크가 검출되었다. 이는 CPN 구조에 galactose가 결합함에 따라 화합물의 전체적인 극성이 증가하여 역상 칼럼 내에서의 용리 시간이 단축된 결과로 해석된다. Figure 3에서 보이는 바와 같이 분석 결과 CPN-gal의 8.5분 부근에서 미량의 표준 물질 CPN 피크가 관찰되었으나, 그 양은 매우 미미하였다. 이를 제외하고는 다른 피크는 관찰되지 않았으며 정량 분석 결과 CPN-gal은 약 99% 이상의 높은 순도를 나타내었다. 이를 통해 본 실험에서 수행한 용매 분획 및 정제 공정이 고순도의 배당체를 수득하기에 적합함을 확인하였다.
| TIME | H2O | ACN |
|---|---|---|
| 0 | 70 | 30 |
| 25 | 50 | 50 |
| 30 | 0 | 100 |
| 35 | 0 | 100 |
| 36 | 70 | 30 |
| 43 | 70 | 30 |
Ⅲ. 결 론
본 실험에서 화장품 보존제로 널리 사용되나 허용 농도 범위를 넘으면 피부 자극을 일으키는 CPN의 물성을 개선하기 위해 β-galatosidase를 이용한 생합성을 통해 CPN의 배당체인 CPN-gal을 성공적으로 합성하였다. 합성된 반응물은 용매 분획, 당 침전 및 실리카겔 칼럼 크로마토그래피로 이어지는 정제 공정을 통해 효율적으로 분리되었다. HPLC 분석 결과 정제된 CPN-gal은 99% 이상의 높은 순도를 나타내었으며, CPN 대비 단축된 용리시간을 통해 galactose 도입에 의한 분자의 극성이 변하고 친수성 증가를 확인하였다. 결론적으로 CPN-gal의 고순도 생산을 위한 최적의 합성 및 정제 프로토콜을 확립하였으며 이는 향후 CPN-gal을 활용한 저자극성 및 기능성 화장품 소재 개발에 크게 기여할 수 있을 것으로 기대된다.