Ⅰ. 서 론
오랜 기간 한약재로 사용되었던 인삼은 항암, 항염, 항산화, 치매, 항당뇨 등의 효능이 있는 것으로 알려져 있다. 이와 같은 효능은 인삼 속의 사포닌 성분인 진세노사이드(ginsenosides)로부터 유래된다(1-5). 진세노사이드는 배당체의 형태를 띠며, 그 종류가 매우 다양하고 각각의 기능을 가지고 있다. 진세노사이드의 90% 이상에 해당되는 major 진세노사이드는 분자량이 큰 형태로 존재하고 있으며 생체 내의 흡수율이 낮다. 이는 섭취 시 장내미생물의 당 가수분해를 통해 분자량이 작은 minor 진세노사이드로 전환되어 흡수된다. Minor 진세노사이드는 major 진세노사이드보다 뛰어난 약효를 가지고 있지만 미량 함유되어있고, 사람들의 체질 혹은 식습관에 따라 장내미생물의 종류와 분포도가 다르기 때문에 major 진세노사이드를 분해하여 minor 진세노사이드가 생성되는 정도가 다르다. 그로 인해 인삼을 섭취할 때 유용물질의 흡수율이 사람마다 달라 효능의 차이가 있었다. 이러한 문제로 현재는 사람들이 동일한 minor 진세노사이드를 섭취 및 흡수할 수 있도록 제품의 minor 진세노사이드의 함량을 향상시키기 위한 연구들이 진행되고 있다. 그 방법으로 산처리(6, 7), 가열(8), 합성, 미생물발효(9), 효소(10) 등을 이용하고 있다.
인삼의 증숙 및 건조를 통해 생산되는 홍삼은 열에 의해 아미노산 등의 변화가 생기며, Rg2, Rg3, Rh1, Rh2와 같은 minor 진세노사이드가 생성된다(11). 산 또는 알칼리를 이용하는 방법은 당을 무작위로 가수분해시켜 산성 다당체와 minor 진세노사이드를 분해할 수 있다. 이는 특이적인 분해가 이루어지지 않아 약리성분의 변성을 일으킬 수 있다. 진세노사이드의 합성은 많은 연구가 진행되었지만 거의 사용되지 않는다. 최근에는 효소 또는 미생물을 이용한 방법이 많이 연구되고 있는데, 효소 및 미생물을 이용한 방법은 생촉매 기능을 이용하여 major 진세노사이드를 분해하며 사용하는 효소, 미생물에 따라 특이적인 변화를 줄 수 있다는 장점이 있다. 이러한 생물전환(bioconversion)법을 이용하여 건강기능식품, 화장품, 의약품 등의 소재를 생산하고 있다. 본 논문은 인삼에 함유된 진세노사이드의 종류, 장내미생물에 의한 진세노사이드의 변화, 생물전환 등에 대하여 논하고자 한다.
Ⅱ. 본 론
인삼(Panax ginseng C. A. Meyer)은 두릅나무과(Araliaceae) 인삼 속(Panax)에 속하는 식물로 오랜 기간 아시아와 러시아, 유럽 등에서 광범위하게 약재로 사용되어 왔다(12). 인삼의 성분에는 진세노사이드, 지용성 성분, 탄수화물, 비타민 등이 있으며, 인삼 제품은 탕약, 환, 절임과 같은 전통적인 방법과 추출액, 건조 분말 등의 형태로 생산되고 있다(13).
인삼의 약리성분인 진세노사이드는 triterpenoid dammarane의 비당(aglycone)부분에 glucose, xylose, arabinose 등 당(glycone)이 결합된 형태의 배당체 구조를 가지고 있다. 진세노사이드의 구조적 특징에 따라 protopanaxadiol(PPD), protopanaxatriol(PPT) 그리고 oleanane 계열로 나뉜다(14). PPD 계열에는 Rb1, Rb2, Rb3, Rh2, Rc, Rd, Rg3, F2, compound Y(CY), compound K(CK) 등이 있으며, PPT 계열에는 Re, Rf, Rg1, Rg2, Rh1, F1 등이 있다. 그리고 oleanane계열에는 Ro 등이 있다(Figure 1)(15, 16).
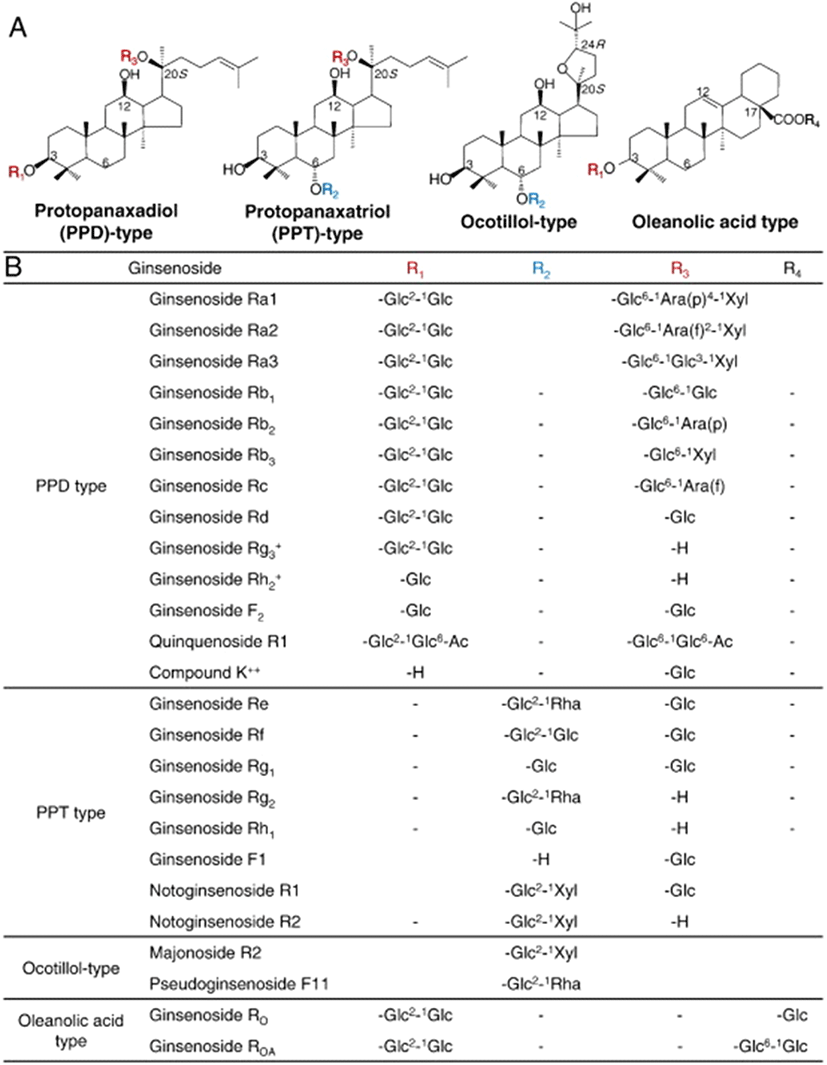
인삼과 홍삼에는 전체 진세노사이드의 90% 이상이 Rb1, Rb2, Rc, Re 등과 같은 major 진세노사이드의 형태로 가지고 있으며, 미량의 F2, Rg3, Rh2, CK와 같은 minor 진세노사이드가 함유되어 있다. Major 진세노사이드는 인체의 소화기관을 거치면서 거의 흡수되지 않는데, Rb1의 경우 4.35%의 매우 적은 양이 체내 흡수되며(17), 대개는 장내미생물에 의해 Rb1이 CK로 전환되어 흡수된다고 알려져 있다(18).
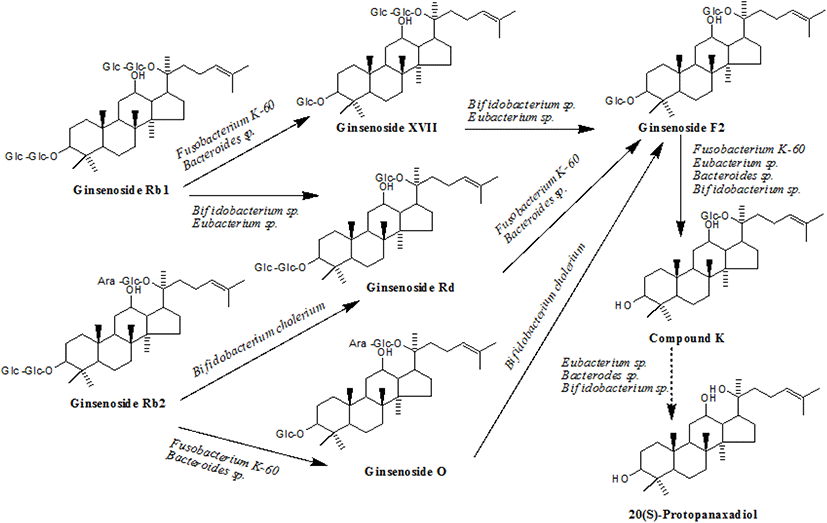
인삼을 섭취하면 major 진세노사이드는 장내미생물 효소인 β-glucosidase에 의하여 배당체의 glycoside 결합이 끊어지며, Rb1 → Rd → F2 → CK, Rb2 → CK, Rc → Mc → CK, Re → Rg1 → F1 → PPT, Rg1 → F1 → PPT 경로로 전환된다(19). PPD 계열의 대사과정에 관여하는 장내 미생물에는 Bacteroides, Bifidobacterium, Eubacterium, Fusobacterium 등이 있으며, PPT 계열에는 Bacteroides, Fusobacterium, Eubacterium 등이 관여한다(Figure 2). 장내미생물이 생산하는 효소 β-glucosidase, β-xylosidase, α-arabinofuranosidase 등에 의해 PPD 계열은 CK로 전환되고, α-rhamnosidase, β-glucosidase 등에 의해 PPT 계열이 Rh1 또는 protopanaxatriol로 전환된다(17, 20-25).
진세노사이드를 분해할 수 있는 장내미생물의 분포와 기능은 민족 차이, 개인의 식습관, 건강상태, 스트레스 정도, 체질 등에 따라서 다르다(26). 또한, 항생제의 복용은 장내미생물의 분포에 큰 변화를 가져오며, 위장관계 질환, 신경계 질환, 암 등 질병과도 연관되어 있다(27, 28). 그러므로 장내미생물의 종류에 따라 분해 및 흡수되는 진세노사이드의 종류가 다를 수 있다(29, 30). 진세노사이드는 diol 형태 혹은 triol 형태로 흡수되거나, 진세노사이드 분해 미생물의 부재로 인체에 흡수가 되지 못하는 경우도 있다(17, 31-33). 한국인을 대상으로 이들 장내미생물의 진세노사이드 분해능을 조사했을 때, 37.5%는 diol과 triol 형태 모두 혹은 한 가지를 이용하지 못하는 것으로 나타났다(Figure 3)(34).
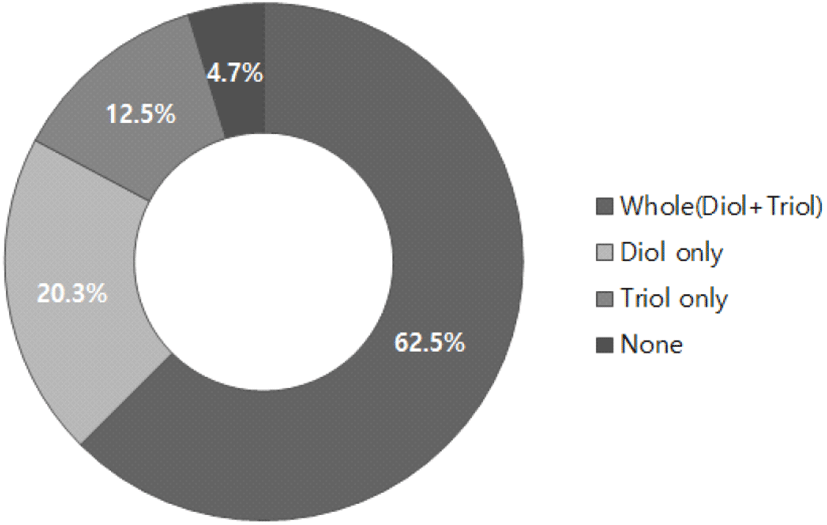
최근에는 개인의 장내미생물 차이로 인한 진세노사이드의 흡수율 및 효능 저하의 문제를 해결하기 위하여 미생물이나 미생물 유래 효소를 활용한 진세노사이드의 생물전환 기술이 이용되고 있다(35, 48). 인삼 진세노사이드의 생물전환 방법은 배당체의 β-glucoside 결합을 끊을 수 있는 β-glucosidase, β-glycosidase, β-galactosidase, lactase, cellulase 등의 효소를 직접 이용하거나 이들을 생산하는 미생물을 활용하는 것이다. 현재까지 분리된 진세노사이드 생물전환능 미생물은 장내미생물을 비롯하여 토양균, 곰팡이, 유산균 등이 있다. 그러나 미생물을 식품에 적용하기 위해서는 안전한 균주(GRAS 균주)여야 하며, 배양이 쉬워야 한다(36). 이러한 조건을 만족하는 미생물 중에서 대표적인 것이 유산균이며, 이를 활용한 진세노사이드의 산업적 생물전환도 활발하게 이루어지고 있다. 즉, β-glucosidase 효소 활성이 우수한 유산균을 선발하여 대량 배양한 후 효소를 정제하여 사용하거나, 유산균 자체를 직접 생물전환에 활용한다(4). 따라서 유산균의 효소 활성 및 특이성의 차이로 인해 다양한 생물전환물질을 선택적으로 생산할 수 있다(Table 1).
| Strains | Transformation pathways | References |
|---|---|---|
| Lactobacillus brevis | Rb1 → Rd, gypenoside XVII → F2 → CK | (37) |
| Rd → F2 → CK | (38) | |
| Rb1 → Rd → F2 → CK | (13) | |
| Lactobacillus helveticus | Rb1 → Rd → Rg3 → Rh2; Re → Rg1 → Rh1 | (39) |
| Lactobacillus paralimentarius | Rb1 → Rd, gypenoside XVII → F2 → CK | (40) |
| Lactobacillus pentosus | Rb1 → Rd, gypenoside XVII → F2 → CK | (41) |
| Lactobacillus plantarum | Rb1 → Rd | (42) |
| Rb2, Rb3 → Rd | (43) | |
| Lactobacillus rhamnosus | Rb1 → Rd | (44) |
| Leuconostoc citreum | Rb1 → Rd, gypenoside XVII → F2 → CK | (45) |
| Leuconostoc mesenteroides | Rb1 → Rg3, Rg5 | (46) |
| Rb1, Rb2 → Rg3; Re → Rg1 | (47) | |
| Leuconostoc paramesenteroides | Rb1 → CK | (43) |
| Pediococcus pentosaceus | Rb1 → Rd → Rg3 → Rh2; Re → Rg1 → Rh1 | (39) |
| Rb1 → Rg3, Rg5 | (46) |
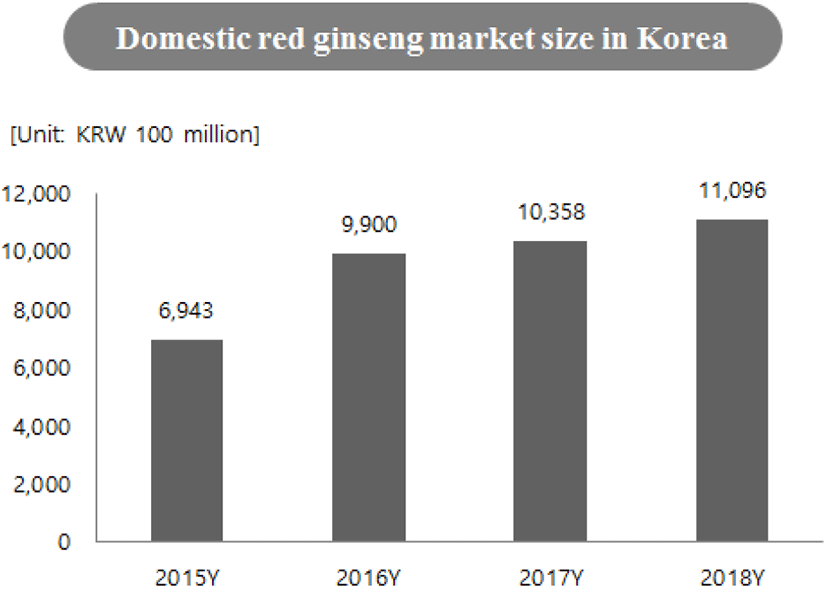
산업체를 중심으로 생물전환기술을 이용한 발효 인삼 및 발효 홍삼 제품을 개발하기 위한 연구가 활발하게 진행되고 있고 실제 제품화되어 시장에 출시되고 있다. 건강기능식품에 대한 소비자들의 선호도가 향상되면서 홍삼제품에 대한 수요도 크게 증가하고 있으며(Figure 4), 이와 더불어 발효삼에 대한 수요도 꾸준히 향상될 것으로 기대된다. 국내뿐만 아니라 중국, 일본, 홍콩, 미국 등 외국에서도 인삼 및 홍삼에 대한 수요도가 높아 발효삼에 대한 국내외 시장 확대가 기대된다. 그러한 수요에 부응하기 위해서는 꾸준한 기술개발이 필요하며, 산업체를 중심으로 홍삼제품의 기능성 향상을 위한 다각도의 노력을 하고 있다(49).
Ⅲ. 결 론
고령화시대가 되면서 사람들은 질병을 예방하기 위해 건강기능식품에 많은 관심을 가지고 있다. 수요 증가에 따라 건강기능식품 시장이 확대되고 있으며, 기능성 향상에 대한 소비자들의 요구도가 높아지고 있다. 한국인들이 가장 선호하는 건강기능식품은 홍삼제품이며 남녀노소 모두가 건강을 위해 섭취하고 있다. 그러나 인삼이나 홍삼에 함유되어 있는 사포닌인 진세노사이드는 개인의 장내 환경 즉 장내미생물 균총의 차이로 인해 이용도와 효능에서 차이가 있다. 즉, 같은 제품을 먹어도 개인에 따라 그 효능이 다르게 나타나는 것이다. 이러한 문제를 해결하기 위하여 학계와 산업계에서는 진세노사이드를 생물전환하는 기술에 관심을 가지게 되었고 생물전환능을 가진 미생물과 그 효소에 대한 특성 규명이 이루어져 왔다. 이러한 기술개발은 인삼이나 홍삼에 포함된 진세노사이드의 생물전환을 통하여 인체 흡수력이 향상되고 또한 효능도 증대되어 그 효과가 크게 나타날 수 있다. 현재 홍삼제품이 국내 건강기능식품 매출액 1위를 유지하고 있고 중국 등 외국에서도 국내 홍삼제품에 대한 선호도가 아주 높아 미생물 생물전환을 통하여 기능성이 향상된 발효 인삼 및 발효 홍삼이 개발된다면 그 시장은 확장될 것으로 기대된다.






